Bugün öğrendim ki: İnsan yumurtasının döllenmesi sırasında yüzeyinden milyarlarca çinko iyonu çıkarıldığında, çinko kıvılcımı olarak da bilinen mikroskobik inorganik bir ışık parlaması salınır.
Erken gelişimin kritik bir penceresi, olgun bir yumurtanın gelişmekte olan bir embriyo1'ya geçişini işaretleyen bir dizi olay olan yumurta aktivasyonudur. Bu olaylar, polispermiye karşı blok, mayozun tamamlanması, maternal mRNA alımı ve pronükleer oluşumu1 kapsar. Sperm kaynaklı oosit aktive edici faktörler - fosfolipaz C (PLCζ) gibi - tarafından döllenme üzerine tetiklenen yumurtadaki farklı sitoplazmik kalsiyum geçici desenleri, yumurta aktivasyonunun2 belirli olaylarını belirler. İlginç bir şekilde, zigot tarafından üretilen spesifik kalsiyum geçici profilleri embriyo kalitesi3,4,5,6 ile oldukça ilişkilidir. Dahası, zigottaki doğal kalsiyum geçici deseninin değiştirilmesi, embriyo ve yavru gelişiminde7 uzun süreli gen ifadesi etkilerine sahip olabilir. Yumurtadaki kalsiyum geçici desenleri gelişimsel sonuçların göstergesiyken, bu geçicilerin izlenmesi hücre içi görüntüleme boyalarını gerektirir ve bu nedenle bu biyolojik okumanın klinik uygulamasını engeller.
Son zamanlarda, biz ve diğerleri, kemirgen, domuz ve insan olmayan primat türlerinde çinkonun mayoz ve yumurta aktivasyonunda8,9,10,11,12,13,14,15,16,17,18 yer alan başka bir temel element olduğunu göstermiştir. Farede, mayoz olgunlaşması – veya gametin I. mayozun profazında durmuş bir hücreden II. mayozun metafazında durmuş olgun bir yumurtaya ilerlemesi – uygun mayoz ilerlemesi için gerekli olan toplam çinko içeriğinde önemli bir (%50) artışla birlikte gerçekleşir11. Bununla birlikte, döllenmede toplam çinko seviyeleri azalmalıdır ve döllenmenin birkaç dakikası içinde, çinko "çinko kıvılcımı"10,16 olarak adlandırılan bir salgılama olayında zigottan salınır. Fizyolojik olarak, bu çinko salınımı kalsiyum geçicilerini yakından takip eder ve hücre döngüsü düzenleyici protein EMI29,17'nin modülasyonu da dahil olmak üzere yollar aracılığıyla hücre döngüsü devamı için gereklidir. Fare yumurtalarının membran geçirgen çinko şelatörü ile tedavi edilmesi, hücre içi çinko kullanılabilirliğini azaltır ve yumurta aktivasyonunu indüklemek için yeterlidir10,11,17. Ayrıca, inaktive edilmiş sperm başlarının enjeksiyonu ve ardından çinko şelatörü tedavisiyle üretilen diploid embriyolar alıcı farelere transfer edildiğinde canlı ve verimli yavrular elde edilebilir ve bu, kalsiyum salınımlarının tamamen yokluğunda gerçekleşir17. Bu sonuçlar, yalnızca hassas çinko düzenlemesinin yumurta aktivasyonu ve embriyo gelişiminin olaylarını kontrol etmek için yeterli olduğunu düşündürmektedir. Bu nedenle, bir zigotun çinko kıvılcımı profili, gelişim potansiyelinin erken bir hücre dışı belirteci olabilir ve çinkonun modülasyonu değerli bir klinik araç olabilir.
Yumurta aktivasyonu sırasında çinkonun rolü hakkındaki anlayışımız, insan yumurta aktivasyonundan sonraki anlar temel bilim açısından ayrıcalıklı bir zamanı temsil ettiği için model organizmalardaki çalışmalarla sınırlı kalmıştır. Türümüzdeki erken gelişim olayları hakkındaki önemli bilgi boşlukları, hem insan yumurtasının nadir ve eşsiz doğasından hem de partenogenez veya döllenmeyi19,20,21 içeren çalışmalar çevresindeki etik ve yasal kısıtlamalardan kaynaklanmaktadır. Daha önce insan yumurtalarının çinko taşıyıcıları ve kortikal olarak zenginleştirilmiş çinko vezikülleri içerdiğini gösterdik, bu da çinkonun insan yumurta aktivasyonu sırasında önemli bir role sahip olabileceğini düşündürmektedir10,13,16. Bu çalışmanın amacı, model organizmalardan insana çinko kıvılcımı hakkındaki bilgilerimizi genişletmekti. Üç bağımsız yumurta aktivasyon yöntemi (kalsiyum ionomycin, ionomycin ve hPLCζ cRNA) kullanarak, çinko akışını insan yumurta-embriyo geçişinin inorganik bir imzası olarak tanımlar ve yalnızca hücre içi çinkonun şelasyonunun yumurta aktivasyonunu indüklediğini gösteririz. Bu deneyler, yalnızca insan yumurta aktivasyonunun temel biyolojisini daha fazla tanımlamakla kalmaz, aynı zamanda çinko akışını klinik olarak gamet potansiyelinin bir okuması olarak hücre dışı çinko kıvılcımı profilini çözmek ve çinko şelasyonunu bir aktivasyon yöntemi olarak geliştirmek için uygulama temellerini de atar.
Çinko kıvılcımları partenogenetik aktivasyon ile ilişkilidir
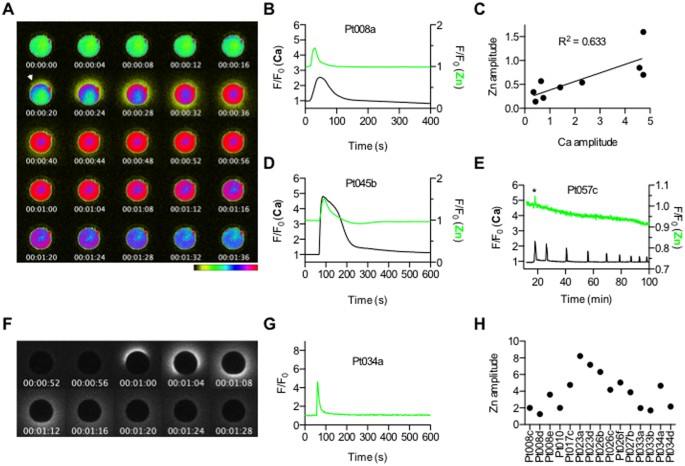
Farede, olgun metafaz II'de durmuş (MII) yumurtaların (burada yumurta olarak anılacaktır) ya döllenme ya da kimyasal yollarla aktivasyonu, hücrenin çinko içeriğinin yaklaşık %20'lik bir kaybını oluşturan yumurta korteksinde zenginleştirilmiş veziküllerden çinkonun ekzositozunu uyarır ve bu tür çinko kıvılcımları iki insan olmayan primat türünde de belgelenmiştir10,16. İnsan yumurta aktivasyonu sırasında çinko kaybının meydana gelip gelmediğini incelemek için, önce insan yumurtalarını, yumurtaya doğrudan dışsal kalsiyum veren ve hücre içi kalsiyumun endojen depolarında bir artışa neden olmak için gereken sperm kaynaklı sinyal kaskadlarını atlayan kalsiyum iyonofor, Ca-ionomycin ile tedavi ettik22. Daha sonra, sırasıyla Fluo-4-AM ve FluoZin-3 boyaları kullanarak canlı hücre görüntüleme ile bireysel yumurtalardaki hücre içi kalsiyum ve hücre dışı çinko dinamiklerini izledik. Çinko, 20 μM Ca-ionomycin'e maruz kaldıktan birkaç saniye içinde hücre içi kalsiyumdaki artışla koordineli olarak insan yumurtasının çevresinden salındı (Şekil 1A,B, Film S1). Çinko kıvılcımı ve kalsiyum geçicisi arasında pozitif bir korelasyon vardı, daha büyük bir hücre içi kalsiyum dalgası daha büyük genlikli çinko ekzositozu ile ilişkilendirildi (Şekil 1C). Ayrıca, endojen kalsiyum depolarının salınımını uyaran, ionomycin (apo formu, Ca olmadan) ve insan PLCζ (hPLCζ) cRNA'nın mikroenjeksiyonu da dahil olmak üzere iki ek yaklaşım kullanarak yumurta aktivasyonu ile indüklenen çinko kıvılcımını doğruladık. Erkek spesifik PLCζ, fosfatidilinositol (4,5)-bifosfat hidrolizinden inositol 1,4,5-trifosfat (IP3) oluşturarak sperm kaynaklı Ca2+ salınımlarını yeniden üretir. Bu reaksiyon, memeli döllenmesinde hücre içi depolarlardan IP3 aracılı Ca2+ salınımının yer almasını destekler23,24. Bu yaklaşımlar, ilk kalsiyum geçicisiyle sıkıca koordine edilmiş çinko kıvılcımları ortaya çıkardı (Şekil 1D,E). Önemli olarak, çinko kıvılcımı yalnızca yumurta aktivasyonu sırasında FluoZin-3 ile çinko ekzositozu izlenirken de gözlemlendi, bu da sinyalin kalsiyum görüntülemesinin bir artefaktı olmadığını gösterdi (Şekil 1F,G). Dikkat edilmesi gereken bir nokta, bireysel yumurtalar arasında ve bireysel katılımcılar arasında çinko kıvılcımı genlik profillerinde, gamet kalitesindeki altta yatan farklılıkları düşündüren farklılıklar olmasıdır (Şekil 1H). Bu nedenle, çinko kıvılcımının insan yumurta aktivasyonu sırasında meydana geldiğini ve hücre içi kalsiyum geçicisine paralel olduğunu bildirebiliyoruz.
Çinko kıvılcımı potansiyelinin kazanımı mayoz aşamasına bağlıdır
Çinko kıvılcımının döllenme yetenekli gametlerin bir özelliği olup olmadığını belirlemek için, olgunlaşmamış profaz I'de durmuş germinal vezikül-sağlam (GV) oositlerin (burada oosit olarak anılacaktır) çinko kıvılcımı profillerini olgun yumurtalarınkilerle karşılaştırdık (Şekil 2, Film S2). İlk olarak, karıştırıcı değişkenleri en aza indirmek için katılımcı eşleşen örneklerle (yani, aynı bireyden GV oositleri ve MII yumurtaları) Ca-ionomycin tedavisi sırasında hücre dışı çinkoyu izleyerek bu karşılaştırmayı yaptık. Bu yaklaşımı kullanarak, 6 katılımcının 4'ünden örneklerde MII yumurtalarında GV oositlerine kıyasla çinko kıvılcımı genliğinin daha yüksek olduğunu bulduk (Şekil 2A–C). Birden fazla katılımcıdan alınan GV oositleri ve MII yumurtalarının bir alt kümesinde, hem hücre içi kalsiyumu hem de hücre dışı çinkoyu izledik ve kalsiyum geçici genlik oranını çinko kıvılcımı genliğine karşılaştırdık (Şekil 2D). Kalsiyum geçici genliğinin çinko kıvılcımı genliğine oranı, bir hücrenin hücre içi kalsiyumdaki artışlara ne kadar iyi yanıt verebileceğinin güçlü bir göstergesidir, daha küçük oranlar daha güçlü çinko yanıtlarına karşılık gelir. MII yumurtalarının GV oositlerine kıyasla ortalama olarak daha küçük bir oran sergilediğini bulduk, bu da MII yumurtalarında çinko kıvılcımlarının hücre içi kalsiyum geçicilerine göre daha belirgin olduğunu gösteriyor (Şekil 2D).
Bu bulguları farede daha da doğruladık (Ek Şekil 1). Gonadotropin uyarılmış farelerden GV oositleri ve MII yumurtaları topladık ve paralel olarak ionomycin ile indüklenen yumurta aktivasyonuna yanıt olarak çinko ekzositozunu izledik (Ek Şekil 1). İnsanda gözlemlendiği gibi, partenogenetik aktivasyondan sonra çinko kıvılcımı ortaya çıkarma yeteneğinin mayoz olgunlaşma bağımlılığının olduğunu bulduk (Ek Şekil 1). Bu nedenle, incelenen türler arasında, mayoz aşaması ve çinko kıvılcımı yanıtı arasında güçlü bir korelasyon vardı, profaz I'de durmuş gametler ortalama olarak metafaz II aşamasındakilere göre daha küçük bir çinko kıvılcımına sahipti. Bu sonuçlar, çinko kıvılcımını ortaya çıkaran mekanizmanın muhtemelen döllenmeden hemen önce tamamen kurulmadığını, bu da erken yumurta aktivasyonunu önlemek için önemli bir mekanizma olabileceğini düşündürmektedir. Farede, çoğunlukla çinko taşıyıcıları ZIP6 ve ZIP1013 tarafından düzenlenen hücre içi çinkoda önemli bir artış, mayoz olgunlaşması sırasında gerçekleşir. Ayrıca, profaz I ve metafaz II arasında gamette belirgin bir kortikal vezikül dağılımı polarizasyonu da meydana gelir ve bu veziküller çinko kıvılcımının kaynağıdır16. Bu nedenle, muhtemelen korunmuş olan, insan gameti hem ZIP6 hem de ZIP10'u ifade ettiği ve noktasal vezikül benzeri yapılara yerleşmiş labil çinkoya sahip olduğu için13, gametin çinko kıvılcımı üretme yeteneğinin zamansal-mekansal bir düzenlemesi vardır.
Çinko kıvılcımı kapasitesinin kazanımı ve yumurta aktivasyonunun zamanlaması arasındaki bu sıkı koordinasyon, kortikal granül ekzositozu (CGE) ve kalsiyum geçicileriyle gözlemlenenlerle paraleldir. Örneğin, kortikal granüller, Zona Pellucida Glikoprotein 2'yi kesen proteazlar içeren ve polispermiye karşı bloğun kurulmasında yer alan salgılayıcı yapılardır. Profaz I'de durmuş gametler, döllenme sırasında meydana gelenlere benzer kalsiyum geçicileri indükleyen tedavilerle uyarıldığında bile, CGE geçirmek için olgun MII yumurtalarına göre daha az yeteneklidir26. Hem CGE hem de çinko ekzositozu kalsiyuma bağlı olaylardır, bu nedenle sonuçlarımız, yumurtanın tekrarlayan kalsiyum geçicileri ortaya çıkarma yeteneğinin de mayoz ilerlemesi boyunca arttığı bilgisine uygundur. Örneğin, GV oositleri, MII yumurtaları27,28 kadar verimli bir şekilde kalsiyum geçicilerini başlatamaz ve koruyamaz. Ionomycin'e yanıt olarak, fare MII yumurtaları GV oositlerine kıyasla önemli ölçüde daha büyük bir kalsiyum yanıtı sergiler ve en büyük değişiklik I. mayozun metafazyası ve MII29 arasında gözlemlenir. Bu farklı kalsiyum geçici yanıtı, kalsiyum kanal modifikasyonları ve yoğunlukları, endoplazmik retikulum (ER) yeniden düzenlemesi ve ER kalsiyum depolarındaki artışlar30 da dahil olmak üzere kalsiyum homeostazı mekanizmalarında mayoz olgunlaşmasıyla ilişkili değişikliklerden kaynaklanmaktadır. Bu nedenle, çinko kıvılcımı potansiyelinin kazanımının, kalsiyum29 için zaten gösterilenlerle aynalanmasını bekliyoruz. Bununla birlikte, gametin maksimum çinko kıvılcımı yanıtını elde edebildiği mayoz olgunlaşması sırasında kesin zamanlamayı tanımlamak için gelecekteki çalışmalar gereklidir.
Hem fare hem de insan GV oositleri, MII yumurtalarına göre ionomycin aktivasyonuna yanıt olarak çinko kıvılcımı üretme yeteneğinde önemli ölçüde azalmış olmasına rağmen, fare GV oositlerinin yanıtı genel olarak insan GV oositlerine kıyasla daha üniform ve azalmıştı. Bu tutarsızlık, kalsiyum mekanizması ve sinyalleşme mekanizmalarındaki türlere özgü farklılıkları yansıtabilir. Örneğin, hamster GV oositleri, MII yumurtalarında bulunan IP3'e duyarlı kalsiyum depolarının yaklaşık %80'ini zaten içerir31. Alternatif olarak, fare ve insan gametlerinin kalitesinde doğal farklılıklar olabileceğini göz ardı edemeyiz. Örneğin, fare GV oositleri, tamamen gelişmiş oositlerin senkronize bir popülasyonunu zenginleştiren gonadotropin uyarım protokollerini takiben elde edildi, oysa insan GV oositleri, hiperstimülasyondan sonra mayozları devam ettiremedikleri için elde edildi ve muhtemelen kalite olarak daha çeşitlidir. Bu olasılık, insan gametleri üzerinde temel araştırmalar yapmanın içsel zorluklarını vurgular - yani oositlerin çoğunun, klinik kullanım için gelişimsel ve/veya morfolojik kriterleri karşılamadıkları için Yardımcı Üreme Teknolojileri (YÜT) döngülerinden atılanlardır ve örnek boyutu sınırlıdır. Bu zorluklara rağmen, temel araştırmalar için benzer insan oosit popülasyonlarının kullanılması, insan yumurta biyolojisi32,33,34 hakkında önemli bilgiler vermiştir.
Burada açıklanan çalışma, insan yumurtasının temel biyolojisi hakkında yeni bilgiler sağlamanın yanı sıra, iki farklı şekilde YÜT için önemli translasyonel etkiye de sahiptir. İlk olarak, bir spermin doğrudan yumurtaya mikroenjekte edildiği işlem olan intrasitoplazmik sperm enjeksiyonu (ICSI), başlangıçta erkek faktör infertilitesini aşmak için geliştirilmiş ancak şu anda klinik YÜT'de yapılan işlemlerin yaklaşık %70'ini oluşturmaktadır (www.sart.org). ICSI, %70 oranında başarılı döllenme ile sonuçlansa da, yumurtanın düzgün bir şekilde aktive edilememesi nedeniyle vakaların %5'ine kadar tam döllenme başarısızlığı hala meydana gelir25. Düşük döllenme potansiyeline sahip hastalarda ICSI başarısını iyileştirmek için, ICSI ve yumurta aktivasyonunu birleştiren yöntemler klinik olarak uygulanmıştır. Yardımcı Oosit Aktivasyonu (AOA) olarak adlandırılan bu teknik, kalsiyum iyonofor veya PLCζ23,25 gibi döllenme ile indüklenen hücre içi kalsiyum artışını taklit eden veya indükleyen yaklaşımlara dayanır. AOA kullanılarak başarılı gebelikler bildirilmiştir35. Hücre içi bir çinko şelatörünün insan yumurtalarını aktive edebileceğini ve bu nedenle AOA'da önemli uygulamalara sahip olabileceğini gösterdik. Farede, döllenme ile indüklenen çinko kıvılcımı, kalsiyum geçicilerinin aksine, yumurta aktivasyonunun ilk birkaç dakikasıyla sınırlıdır (Zhang vd., Sci Reports, kabul edildi). Bu dar pencere nedeniyle, hücre içi çinko kullanılabilirliğinin azaltılması, yumurta aktivasyonunu yönlendirmek için daha hedefli ve spesifik bir yaklaşım olabilir ve böylece AOA'nın etkinliğini artırabilir. Önemli olarak, TPEN aracılı AOA, murine ve porcin modellerde sağlıklı canlı yavrularla sonuçlanmıştır14,17.
İkincisi, gamet fonksiyonunda çinkonun fizikokimyasal rollerinin anlaşılmasındaki gelişmeler, çinko kıvılcımının insan yumurtasında yumurta aktivasyonunu takiben hızla meydana gelmesi ve hücre dışı alanda tespit edilebilmesi nedeniyle klinik etkiye sahip olabilir. Dahası, bireysel yumurtalar arasında hem çinko kıvılcımı hem de kalsiyum geçici profillerinde, altta yatan kalite farklılıklarını düşündüren varyasyonlar vardır. Aslında, insanda yapılan zarif çalışmalar, sperm ile indüklenen yumurta aktivasyonunu takiben kalsiyum geçici profillerinin, yumurta kalitesi parametrelerine4 bağlı olarak farklı olduğunu göstermiştir. Örneğin, in vitro olgunlaşma, uzatılmış kültür ve vitrifikasyon ve çözülme dahil olmak üzere gamet kalitesini azaltması bilinen süreçlerin tümü, döllenme sırasında kalsiyum geçicilerinin frekansını ve genliğini değiştirir4. İnsanda, döllenme sırasında çinko dinamikleri ile sonraki embriyonik gelişim arasındaki doğrudan ilişkiyi kurmak mümkün olmamıştır. Bu önemli bilgi boşluğunu gidermek için, farede ilk çinko kıvılcımının parametrelerinin (genlik ve toplam çinko salınımı) artan kaliteli blastosistlerle yakından ilişkili olduğunu gösterdik (Zhang vd., Sci Reports, kabul edildi). Şu anda insan çinko kıvılcımını invaziv olmayan, güvenli ve etkili bir şekilde tespit etmek ve nicelleştirmek için platformlar geliştirmek için çabalar devam etmektedir. Özellikle, döllenmeyi takiben medyadaki ekzositoz edilmiş çinkonun ölçülebileceği yöntemlere ihtiyaç vardır, böylece zigotun hem boyalara hem de görüntüleme için gereken zararlı fotonlara maruz kalması sınırlandırılır. Çinko kıvılcımı teknolojisi, mevcut embriyo seçimi yöntemlerine göre birkaç avantaja sahiptir, çünkü bu biyolojik fenomen döllenmenin birkaç dakikası içinde hücre dışı olarak meydana gelir ve spesifik çinko kıvılcımı profilleri, implantasyondan önceki embriyo gelişimiyle yakından ilişkilidir ve bunu tahmin eder (Zhang vd., Sci Reports, kabul edildi). Bu nedenle, embriyoları döllenme ile indüklenen çinko kıvılcımı profiline göre seçmek, uzatılmış embriyo kültürü ve çoklu embriyo transferi ihtiyacını en aza indirecektir - her ikisi de ölçülebilir risklere sahiptir36,37,38,39. Bu tür değişiklikler, dünya çapında milyonlarca doğumun artık hesabını yapan YÜT için üreme sonuçlarını iyileştirecektir.
İnsan gamet elde edilmesi
Yumurta aktivasyonu deneyleri için kullanılan dişi gametler yalnızca Illinois Üreme Merkezi'nden (FCI) elde edildi ve bu yumurta aktivasyonu çalışmalarının tüm yönleri, Northwestern Üniversitesi'nin Kurumsal İnceleme Kurulu (IRB) yönergelerine ve IRB onayına uygun olarak yapıldı. Planlı infertilite tedavisi için intrasitoplazmik sperm enjeksiyonu (ICSI) geçiren katılımcıları işe aldık ve yazılı bilgilendirilmiş onamı takiben, aksi takdirde rutin uygulama olarak atılacak olgunlaşmamış dişi gametleri topladık. FCI'da, yalnızca geri alma işleminden 2 saat içinde MII aşamasında olan yumurtalar klinik olarak inseminasyon için kullanılır ve diğer tüm olgunlaşmamış hücreler atılır. Bu atılan materyali araştırma laboratuvarında geri alma işleminden yaklaşık 3-5 saat sonra elde ettik. Olgunlaşmamış oositleri FCI'dan Northwestern Üniversitesi'ne taşımak için, HEPES ile takviye edilmiş ve %10 Quinn's Advantage Serum Protein Substitute (Origio, Trumball, CT) içeren Quinn's Advantage Medium'da 37 °C'de tutulan taşınabilir bir inkübatörde tıbbi bir kurye kullanıldı.
Araştırma laboratuvarımıza ulaştığında, gamet örnekleri ilgili katılımcı kimliği (Pt00X) ile etiketlendi ve her gamet ışık mikroskobu ile değerlendirildi. Yalnızca doğru mayoz aşamasında olan morfolojik olarak normal hücreler, yumurta aktivasyonu ve canlı hücre görüntülemeyi içeren aşağı akış deneyleri için kullanıldı. Bu nedenle örnek boyutu, seçim kriterlerini (kadın, ≥18 yaşında, İngilizce konuşan, kanser dışı tanı için IVF-ICSI tedavisi gören ve bilgilendirilmiş onam belgesini imzalayan) kesinlikle karşılayan katılımcıların mevcudiyeti ve gametlerinin kalitesiyle sınırlıydı. Alındığında, hücrelerin %33'ü sağlam bir germinal vezikül (GV) ile I. mayozun profazında durmuştu, %30 mayozları devam ettirmişti ancak II. mayozun metafazına (MII) ulaşmamıştı, %22 MII'ye ulaşmıştı ve %15 dejenere olmuştu (Ek Şekil 2A). Hücreler ya hemen kullanıldı ya da MII aşamasına kadar daha fazla in vitro olgunlaştırıldı. Önemli olarak, GV oositleri gerektiren deneylerde (Şekil 2), bu mayoz aşamasındaki hücreler geliş üzerine hemen kullanıldı ve ek in vitro olgunlaştırmaya (IVM) tabi tutulmadı. IVM için, gametler, %5 CO2'de 37 °C'de 4 kuyulu plakalarda önceden dengeye getirilmiş SAGE IVM ortamına (Origio) yerleştirildi. Geliş üzerine GV-sağlam aşamasında olan hücreler MII'ye ulaşmak için 28,0 ± 6,8 saat sürdü, oysa geliş üzerine zaten GVBD geçirenler yalnızca 15,8 ± 9,7 saat sürdü. Genellikle insan oositinin IVM'den sonra MII'ye ulaşması 36-42 saat sürer32. Bu zamanlamaya dayanarak, çalışmamızda kullandığımız hücreler büyük ölçüde mayoz yetenekli idi ve hala yumurtalıktayken mayozları devam ettirmişti, ancak sadece dağılımın gecikmiş ucundaydı. Bu çalışmada kullanılan tüm hücreler, sitoskeleton analizi ile değerlendirildiği gibi normal görünen hücresel ve alt hücresel morfolojiye sahipti (Ek Şekil 2B). Deneysel tedaviler, en az üç ayrı katılımcının hücrelerinde test edildi. Açıklandığı gibi, tüm veriler bu çalışmaya dahil edildi.
Hayvan bakımı ve refahı
Bu çalışmada kullanılan hayvanlar, Ulusal Araştırma Konseyi'nin Hayvan Bakımı ve Refahı Yönergelerine göre ele alındı. Bu prosedürler, Northwestern Üniversitesi'ndeki Kurumsal Hayvan Bakımı ve Kullanım Komitesi (IACUC) tarafından onaylandı. Tüm deneyler, onaylanan yönergelere uygun olarak yapıldı.
Kimyasallar ve reaktifler
Floresan göstergeleri (FluoZin-3, FluoZin-3-AM, Fluo-4-AM), ionomycin, Ca-ionomycin ve pluronik asit Life Technologies'ten (Grand Island, NY) elde edildi. Amonyum asetat, ionomycin, Ca-ionomycin ve diğer kimyasallar Sigma Aldrich'ten (St. Louis, MO) satın alındı. Ionomycin ve Ca-ionomycin, -20 °C'de DMSO'da tek kullanımlık alikotlar olarak saklandı. TPEN, her kullanımdan hemen önce DMSO'da çözüldü ve tamponlara, tamponların ≤%0,5 DMSO içerecek şekilde seyreltildi. Paraformaldehit Electron Microscopy Sciences'tan (Hatfield, PA) satın alındı.
İyonofor ile MII yumurta aktivasyonunun canlı hücre floresan mikroskobu
Yalnızca Zn görüntülemeli deneylerde, tek gametler, bir kapak camı altlı görüntüleme kabında yağın altında, Ca içermeyen hCZB ortamında 50 μM FluoZin-3'ün (Zn izleme için) uzun ve sığ bir 19 μL damlasının bir ucuna yerleştirildi. Hücre içi Ca ve hücre dışı Zn'nin izlendiği deneylerde, gametler önce 30 dakika boyunca 37 °C'de 1 μM Fluo4-AM (Ca izleme için) ve %0,02 Pluronic F-127 içeren SAGE oosit yıkama ortamında (Origio) inkübe edildi40. Gametler daha sonra boya içermeyen ortamla yıkanıp yukarıda açıklandığı gibi Ca içermeyen hCZB'de 50 μM FluoZin-3'e yerleştirildi. Görüntüleme, 488 nm uyarım ve açık bir pinhole (Leica Microsystems, Buffalo Grove, IL) kullanarak 37 °C'de bir TCS SP5 konfokal mikroskopta yapıldı. Aktivasyondan önce başlangıç floresan görüntüleri elde edildi. Aktivasyon görüntülemesi için, Ca-ionomycin (1 μL), gametin karşı tarafındaki görüntüleme damlasına 20 μM son konsantrasyon elde etmek için verildi. Görüntüleme, Ca-ionomycin ilavesinden hemen sonra başlatıldı. Endojen kalsiyum depoları yoluyla yumurta aktivasyonunu indüklemek için, yukarıda açıklandığı gibi görüntüleme damlasına 20 μM Ionomycin (apo formu, Ca olmadan) eklendi. Yukarıda açıklandığı gibi, en az 5 dakika boyunca her 2 saniyede bir görüntü toplandı. Görüntü analizi, ilgi alanları (ROI) tanımlanarak ve ImageJ41 kullanarak zaman içinde floresan yoğunluğu ölçülerek gerçekleştirildi. Hücre içi ROI'ler hücrenin tüm iç alanı olarak tanımlandı. Hücre dışı ROI'ler hücrenin çevresi etrafındaki bir halka olarak tanımlandı. Halka kalınlığı tüm veri analizleri için korunmuştur.
hPLCζ cRNA mikroenjeksiyonu ile MII yumurta aktivasyonunun canlı hücre floresan mikroskobu
Tam uzunlukta insan PLCζ kodlama dizisini içeren pBluescript RN3 plazmidi (Dr. Rafael Fissore, Massachusetts Üniversitesi-Amherst'ten cömert bir hediye), kodlama dizisinin 3' ucundan ötedeki bir bölgede doğrusallaştırıldı ve T3 mMessage mMachine kiti (Ambion, Austin, TX) kullanılarak in vitro transkripsiyonu yapıldı. mRNA, üretici talimatlarına göre saflaştırıldı. Mikroenjeksiyondan önce, konsantre cRNA (2 mg/ml) ikincil yapıyı azaltmak için 85 °C'de 3 dakika ısıtıldı ve gerektiğinde nükleaz içermeyen suda seyreltildi. hPLCζ cRNA, insan yumurtalarının sitoplazmasına son konsantrasyonlarda 0,05 mg/ml ve 0,2 mg/ml mikroenjekte edildi. Mikroenjeksiyonlar için, insan yumurtaları önce 30 dakika boyunca 37 °C'de 1 μM Fluo4-AM ve %0,02 Pluronic F-127 içeren SAGE oosit yıkama ortamında (Origio) inkübe edildi. Daha sonra yumurtalara hPLCζ cRNA mikroenjekte edildi. Mikroenjeksiyon için, insan MII yumurtaları, ısıtılmış bir platformda 37 °C'ye ayarlanmış, hafif mineral yağ altında %0,05 (a/a) polivinil alkol ve %0,1 (a/a) sukroz (Invitrogen) içeren L-15 ortamı damlalarına transfer edildi. hPLCζ cRNA, cam mikropipetlere geri yüklendi ve bir XenoWorks Dijital Mikroenjektör (Sutter Instrument, Novato, CA) ile verildi. Enjeksiyon hacmi yaklaşık 28-48 pl idi (yumurtanın toplam hacminin %1-3'ü). Yumurtalar daha sonra boya içermeyen ortamla yıkanıp yukarıda açıklandığı gibi hCZB'de 50 μM FluoZin-3'e yerleştirildi.
Çinko şelasyonu ve labil çinko analizi
TPEN tedavisinin hücre içi çinko içeriğini bozup bozmadığını analiz etmek için, insan yumurtaları önce 30 dakika oda sıcaklığında %0,02 pluronik asit takviyeli 10 μM Fluozin3-AM ile yüklendi ve daha sonra yumurtalar, hava içinde %5 CO2 atmosferinde 37 °C'de 30 dakika boyunca %0,5 DMSO içeren veya içermeyen 50 μM TPEN içeren CZB ortamında (Millipore, Temecula, CA) inkübe edildi. Yumurtalar daha sonra 488 nm uyarım ve açık bir pinhole (Leica Microsystems, Buffalo Grove, IL) kullanarak 37 °C'de bir TCS SP5 konfokal mikroskopta görüntülendi. Çinko şelasyonunun hücre döngüsü ilerlemesi üzerindeki etkisini belirlemek için, insan MII yumurtaları, %0,1 PVA içeren veya içermeyen 50 μM TPEN içeren CZB ortamında (Millipore, Temecula, CA) inkübe edildi ve hava içinde %5 CO2 atmosferinde 37 °C'de 2 saat kültürlendi. TPEN, 10 mM stok konsantrasyonunda DMSO'da taze olarak hazırlandı. Kontrol ortamı, TPEN damlalarındakiyle aynı DMSO konsantrasyonunu elde etmek için %0,5 DMSO içerdi. Yumurtalar daha sonra KSOM ortamına (Millipore) transfer edildi ve ek 3 saate kadar kültürlendi. Partenogenetik aktivasyonu takiben genişletilmiş kültür, IRB protokolümüzdeki özelliklerden dolayı mümkün değildi. Kültürün ardından, hücre döngüsü evresini doğrulamak için hücreler aşağıda açıklandığı gibi fiks edildi ve immüno-floresans için işlendi.
İmmüno-floresans ve mikroskopi
Sitoskeletal karakterizasyon (aktin ve tübülin) için, hücreler 37 °C'de 1 saat boyunca PBS'de %3,8 PFA %0,1 Triton-X'te fikslendi. Hücreler, bloklama tamponuna (%0,01 Tween 20, %0,01 NaN3, 3 mg/mL BSA, PBS) transfer edildi ve boyamaya kadar 4 °C'de saklandı. Örnekler, oda sıcaklığında 15 dakika boyunca PBS'de %0,1 Triton-X'te permeabilize edildi, bloklama tamponuyla yıkanıp gece boyunca 4 °C'de 1:100 tübülin-FITC (Cell Signaling, Beverly, MA) ve 1:50 rodamine fallöidin (Life Technologies) içinde inkübe edildi. Daha sonra örnekler bloklama tamponunda 3 × 30 dakika yıkanıp Vectashield® (Vector Labs, Burlingame, CA) kullanılarak lam üzerine monte edildi. FITC ve rodamine floresansı, sırasıyla 488 nm ve 543 nm lazer uyarımı kullanarak bir TCS SP5 konfokal mikroskop (Leica) kullanılarak tespit edildi.
İstatistiksel analiz
Olgunlaşmamış ve olgun gametlerdeki çinko kıvılcımı yanıtı, iki kuyruklu eşleştirilmemiş t-testi kullanılarak karşılaştırıldı. İstatistiksel testler, Prism 5.0 (GraphPad) yazılımı kullanılarak gerçekleştirildi. P < 0,05 istatistiksel olarak anlamlı kabul edildi.