Bugün öğrendim ki: Yetişkin beyinde hâlâ yeni sinir hücreleri üreten sinir öncü hücreleri bulunur. Çocukluktan sonra yok oldukları düşünülüyordu. Bilim insanları bunları 20-78 yaş arası kişilerde buldu. Bu, yaşam boyu beyin hücresi üretmeye devam ettiğimiz anlamına geliyor. Nörodejeneratif hastalıkların tedavisinde olası bir çığır açan gelişme.
Yetişkin memeli beyninde sürekli olarak yeni nöronların üretilebileceğinin keşfi, Nörobilimdeki merkezi bir dogmayı yıkmış ve teorikçiler, evrimciler, nörobiyologlar ve klinisyenler arasında, bunlardan sadece birkaçı olmak üzere, büyük tartışmalar yaratmıştır [1]. Bu doğum sonrası nöronal üretimin fonksiyonel etkisi türe göre tutarlı bir şekilde değişse de, doğumdan sonra nöron üretme yeteneği, kabuklulardan primatlara, insanları da içine alarak, evrimsel sınırlar arasında korunmuş gibi görünmektedir [2, 3]. Bununla birlikte, bu kalıcı nörogenezin derecesi hayvan türlerine göre değişmekte olup, bu özellik, belirli bir beyin devresinde daha fazla nöron işe almanın sağladığı faydalar ile zaten işleyen bir devreye entegre ederken ürettikleri dezavantaj arasında bir değiş tokuştan kaynaklanıyor olabilir.
Yetişkin memeli nörogenezinin varlığını destekleyen ilk gözlem, 1962'de J. Altman tarafından hipokampüste benzer bir gözlem yapmadan önce serebral kortekste keşfedildiğinde ortaya çıkmıştır [4]. Bununla birlikte, yetişkin nörogenez alanı tarih boyunca kavramsal bir dirence (yani, nöronların yaşam süresi kısaysa nasıl uzun süreli bellek izleri korunabilir?) ve bu kışkırtıcı kavramı desteklemek için uygun araçların eksikliğine (yani, yetişkin beyinde hücre bölünmelerinin gözlemlenmesi başlangıçta nörogenezden ziyade gliogenez kanıtı olarak görülmüştür) çekilmiştir. Sonuç olarak, yetişkin nörogenezin yetişkin sıçanlarda Bayer ve meslektaşları tarafından ancak 1980'lerde doğrulanmıştır [5, 6]. Goldman ve Nottebohm'un [7] yetişkin kuş beyinlerinde aynı gözlemleri genişleten çalışmalarına ek olarak, bilim camiası yirmi yıl önce zaten bilinen bir olguya olan ilgiyi yenilemeye başlamıştır. O zamandan beri, bu ilk gözlemler, Eriksson ve meslektaşları, ref. [8]'de, BrdU (5-bromo-3′-deoksiuridin, DNA'yı etiketleyen bir timidinanaloğu) teşhis biyobelirteci olarak tedavi edilen hastalardan ölüm sonrası beyin dokusu elde edebildiklerinde insanlar da dahil olmak üzere çoğu memeliye kadar genişletilmiştir. İlk kez, insan dentat girusunda nöronlarda (yani NeuN+ hücrelerde) BrdU etiketlemesinin ikna edici kanıtlarını bildirmişlerdir [8]. Şimdi biliyoruz ki, iki beyin bölgesi—koku alma soğancığı ve hipokampus—çoğu memeli türünde yaşam boyunca yeni nöronlar dahil etmektedir [9]. Bu bölgelerde, hücre seviyesindeki yenileme statik veya sadece onarıcı değildir, ancak hayvanın çevresi ve/veya iç durumları tarafından empoze edilen zorluklara uyarlanabilir bir yanıttır. Özellikle kemirgen beyninde yetişkin nörogenezi kontrol eden hücresel ve moleküler mekanizmaları anlamak için çok sayıda çalışma yapılmıştır (incelemeler için bkz. ref. [10, 11]). Daha yeni çalışmalar, striatum, amigdala, koku alma korteksi [12] ve hipotalamus [13] dahil olmak üzere diğer beyin bölgelerinde yapısal bir yetişkin nörogenezinin varlığını bildirmiştir (bkz. Kutu 1). Bu derlemede, memeli beyninin yetişkin nörogenik potansiyelini destekleyen çok sayıda kanıta ve bu süreci psikiyatrik bozukluklarla ilişkilendiren bağlantılara odaklanıyoruz.
Kutu 1 Yetişkin nörogenez çoğuldur
Kemirgenlerde, yetişkin nörogenez, subventriküler zona (SVZ) -koku alma soğancığı sistemi kullanılarak kapsamlı bir şekilde incelenmiştir. Orada, yetişkin SVZ'de bulunan astrositler, nöroblast öncül progenisinin bir progenisini üretebilen yavaş bölünen sinir kök hücreleri görevi görür. Bu nöroblastlar rostral göçmen akım boyunca koku alma soğancığı doğru ilerler. Soğancığa ulaştığında, yeni hücreler esas olarak lokal inhibitör nöronlara dönüşür, ancak bunlardan birkaçı uyarıcı nöronlara yol açar [180]. Hipokampusun subgranüler bölgesi (SGZ), yetişkin beyindeki bir diğer nörogenik niştir. Dentat girusunun granül hücre tabakasının hilus tarafını kaplar. Orada, astrositler ara öncüllere yol açarak genç yetişkin sıçanlarda günde yaklaşık 9.000 yeni nöron üretir [181]. Bu öncüller, dentat girusta yerel olarak granül nöronlara olgunlaşır ve CA3 ve CA2 bölgelerine akson projeksiyonları ve moleküler tabakaya dendritik dallanmalar gönderir [9]. Bazı kanıtlar, metabolizmayı, yağ depolanmasını ve cinsel işlevleri etkileme potansiyeline sahip nörogenezin olduğu hipotalamus da dahil olmak üzere diğer beyin bölgelerinde yapısal nörogenezin varlığını da düşündürmektedir [182]. Buna karşılık, striatum, amigdala, substantia nigra ve kortekste bildirilen yetişkin nörogenezinin işlevi hala belirsizdir [183]. Yetişkin beyindeki yeni nöronların kaynağını arayan bazı kanıtlar, striatum veya amigdala'daki yeni oluşan nöronların SVZ'den türetildiğini, hipotalamusta ise öncü hücrelerin çoğalmasının üçüncü ventrikülü kaplayan ependamal hücrelerde gerçekleştiğini göstermektedir. Yetişkin nörogenezinin derecesi, özellikle hipokampus, koku alma soğancığı devresi [184] ve diğer beyin bölgelerinde bildirildiği gibi çevresel maruziyetlere bağlıdır [183]. Laboratuvarlarda yaygın olarak kullanılan zayıf üreme ve barınma koşulları, esaret altında yaşayan hayvanlarda genellikle görülen düşük düzeydeki yetişkin nörogenezinden sorumlu olabilir. Daha doğal ortamlarda hayvan yetiştirme, bir sonraki nesil dizileme teknolojileriyle birlikte, yetişkin nörogenezinin kesin seviyesini ve fonksiyonel etkisini tam olarak takdir etmek için gereklidir.
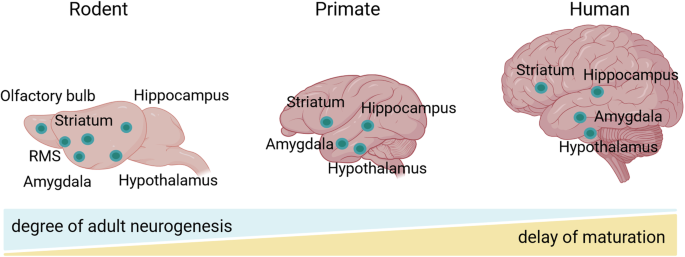
Şimdiye kadar tüm memeli filogenetik ölçeği boyunca hipokampal yetişkin nörogenezinin sistematik çalışmaları yapılmamış olmasına rağmen, birkaç çalışmanın türler arasında yetişkin nörogenezinin derecesinde farklılıklar tanımladığı dikkat çekicidir. Bugün yeni nöronların olgunlaşma hızının türler arasında farklılık gösterdiği açıktır (Şekil 1). Örneğin, Kohler ve meslektaşları, maymunlar ve kemirgenler arasında olgunlaşma hızında önemli farklılıklar göstermektedir [14]. Yazarlar, insan dışı primatlarda kemirgenlere göre daha yavaş bir sinir olgunlaşma oranı bildirmektedir. Bu özellik, yalnızca olgunlaşan nöronların daha yüksek uyarılabilirlik ve daha güçlü sinaptik plastisite sergileyerek benzersiz özelliklere sahip olması nedeniyle çok büyük sonuçlara sahiptir [15]. Başka bir deyişle, yeni nöronların özellikle fonksiyonel olduğu zamansal pencere insan dışı primatlarda diğer türlere göre daha uzun olduğu için, primatlarda hipokampal nörogenezin fonksiyonel etkisi şimdiye kadar hafife alınmıştır. Kohler ve meslektaşları, bu uzun süreli nöronal olgunlaşma döneminin, primatlarda artan bilişsel esneklik ve ayrımcılığı sağlayarak önemli bir evrimsel avantaj sağladığı sonucuna varmıştır. Aşağıda, primatlarda yetişkin hipokampal nörogenezinin varlığını destekleyen kanıtları inceliyoruz.
1980'lerde, kemirgenlerden gelen artan kanıtlar, yetişkin beynin yeni nöronlar entegre edebileceğine topluluğu hızla ikna etmiştir. Ancak, bu bulguların primatlar için ne ölçüde geçerli olduğu tartışmalıdır. Sonuç olarak, hayvan çalışmalarından elde edilen sonuçların primatlara aktarımı yavaşlamıştır. 1985 yılında, 3H-timidin etiketleme yaklaşımını kullanarak Rakic başlangıçta insan dışı primat beyinlerinde yetişkin nörogenezinin olmaması bildirmiştir [16] ve böylece bu tür çalışmaların genel ilgisi ortadan kalkmıştır. Bununla birlikte, radyoaktif olmayan bir hücre bölünmesi belirteci olan BrdU'nun kullanılma olasılığı, alana yeni bir ivme kazandırmıştır. BrdU'yu immünohistokimya ile birleştirmek o kadar kolay hale gelmiştir ki, yetişkin marmosetlerde [17] ve makaklarda [18,19,20,21] kalıcı nörogenezi ortaya çıkaran yeni bir coşku yeniden doğmuştur, ancak nörogenez derecesinin kemirgenlere göre 10 kat daha düşük olduğu bulunmuştur. Daha yakın zamanda, yetişkin nörogenezinin derecesindeki bu çarpıcı fark, önemli bir gelişim sürecinin bir sonucu olarak yorumlanmıştır. Sorrells ve meslektaşları [22], maymunda hipokampal nöronların çoğalmasının juvenil gelişim sırasında hızla azaldığını gösterirken, kemirgenlerde doğum sonrası nörogenez sabit kalmaktadır. Bu nedenle, primat hipokampusunda yetişkin nörogenez, kemirgenlere ve diğer memelilere kıyasla juvenil evreden sonra daha az sağlam kabul edilir, çünkü nöronal öncü hücreler hem daha uzun devir döngüleri hem de daha yavaş olgunlaşma oranları sergiler (Şekil 1). Bu özel kinetik, yazarların primat hipokampusuna genç nöronların alınmasının, embriyogenez sırasında başlayan ve doğumdan sonraki erken evrelerde biten uzun süreli bir gelişim sürecinin hatırlatıcısı olduğu sonucuna varmalarına yol açmıştır.
İnsan dışı primatlarda yetişkin nörogenezine ilişkin fikir birliğinin olmaması, insanlarda varlığını doğrulamak için bir ön koşul olarak kabul edildiği için nörobilimciler için muazzam sonuçlar doğurmuştur. Başka bir deyişle, primatlarda yetişkin nörogenezinin kanıtının olmaması, evrimsel bir bakış açısından, insanlarda yeni nöronların oluşmasıyla tutarsız olarak kabul edilmiştir. Tek hücreli RNA dizilemesi (RNA-seq) gibi yeni teknolojilerin ortaya çıkışı, bu itiraza karşı koymak için yeni bilgiler sağlamıştır. Makakların yaşam süresi boyunca hipokampusta moleküler çeşitliliği ve hücresel heterojenliği ortaya çıkarmak için RNA-seq analizi kullanarak, yetişkin nörogenez açıkça karakterize edilmiştir [23], böylece çalışmasını yeniden değerli hale getirmiştir.
Yetişkin insan beyninde üretilen yeni nöronların ilk gözlemleri, 1990'ların sonlarında [8], ölüm sonrası beyin dokusunda bir dizi hücre bölünmesi belirteci uygulamak ve sonuçları konfokal mikroskopi kullanarak görselleştirmek mümkün olduğunda bildirilmiştir (Tablo 1; ayrıca [3]'e bakın).
O zamandan beri, nöronal oluşum fikri, çeşitli teknikler koku alma soğancığında yeni nöronların varlığını tespit etmekte başarısız olsa da, SVZ'de proliferatif kök hücrelerin varlığına kadar genişletilmiştir [24, 25] [24, 26, 27]. Bu sonuçlarla tutarlı olarak, yetişkin insan beyninde gerçek bir rostral göçmen akımının varlığı henüz tespit edilmemiştir veya yalnızca birkaç nadir bölünen hücre bulunmuştur ([27] ancak ayrıca [28, 29]'a bakın). Konunun yaşı önemli görünmektedir, çünkü dinamik nöroblastlar içeren göçmen bir akımın, koku alma soğancığını ve prefrontal korteksi entegre ettikleri çocuklarda gözlemlendiği, ancak yetişkinlikte gözlemlenmediği bulunmuştur [30].
İnsan hipokampal nörogenezinde benzer bir tartışma yaşanmıştır. Önceki çalışmalar hipokampusta yeni nöronların varlığını göz ardı etmesine rağmen, 14C doğum tarihleme yaklaşımı kullanılarak, insanların kemirgenlerle karşılaştırıldığında benzer derecede yetişkin nörogenez sergilediği, yaşlanma sırasında zayıf bir düşüşle birlikte bildirilmiştir [31, 32]. Çarpıcı bir şekilde, bu teknik ayrıca, Alzheimer hastalığı [33], epilepsi [34] ve Lewy cisimcikleri/Parkinson hastalığı demansı hastalarında [35] yetişkin nörogenezinin derecesindeki değişikliklerle nörolojik hastalıkları ilişkilendirmek için yeni bir ilgi yaratmıştır (bkz. Tablo 1; ve [3]). Benzer şekilde, hipokampal nörogenez, Tablo 1'de açıklandığı gibi ruh sağlığını ilgilendirir. Striatumda yetişkin nörogenez bildirilmiş ancak Huntington hastalığı olan hastalarda muazzam derecede değiştirilmiştir [36, 37]. Önemli olarak, amigdala [38,39,40], hipotalamus [41] ve temporal korteks [40] dahil olmak üzere, insan beyninde kanonik olmayan bölgelerde (bkz. Kutu 1) yetişkin nörogenez de bildirilmiştir.
Bu yeni kanıtlara rağmen, alanda hala tutarsızlıklar bulunmaktadır. Genç nöronların tipik proliferasyon belirteçlerini analiz ederek, bazı çalışmalar, postnatal nörogenez derecesinin dentat girusta çocukluk döneminde keskin bir şekilde düşerek yetişkinlerde ortadan kalktığını tespit etmiştir ([22, 42] ancak ayrıca [43]'e bakın). Aksine, Boldrini ve ark., insan hipokampal nörogenezinin yaşam boyunca devam ettiğini öne sürmüştür [44]. Tüm bu çalışmalar çoğunlukla sırasıyla nöroblastlar ve olgunlaşmamış nöronların iki belirtecinin, DCX ve PSA-NCAM proteinlerinin tespitine dayalı benzer araçlar kullanılarak gerçekleştirilmiştir. Bununla birlikte, immünoboyayı kullanarak yetişkin nörogenezinin derecesini tanımlamak, insanın ölüm sonrası malzemesinde gerçekleştirildiğinde, tutarsızlıklara katkıda bulunmuş olabilecek çok sayıda teknik uyarı sunar [45,46,47]. Ayrıca, DCX ve PSA-NCAM'ın ekspresyonu arasındaki geçen süre, nöronal olgunlaşma oranına göre türler arasında değişebilir. Örneğin, Terreros-Roncal ve ark. [48], PSA-NCAM ekspresyonunun insanlarda DCX'ten biraz önce geldiğini göstermiştir. Bu nedenle, olgunlaşan yeni nöronlarla ilişkili hücre belirteçlerinin basit ekspresyonu zamansal olarak eş zamanlı olmayabilir, bu da bazı araştırmaların eş boyamanın raporlanmasında başarısız olmasının nedenini açıklar. Son olarak, hastaların sağlık öyküsü ve ölüm nedeni, çalışmalar arasında son derece değişkendir (bkz. Tablo 1), yetişkin nörogenezinin derecesini değiştirir.
Bu sorunların bazılarını netleştirmek için, Moreno-Jimenez ve meslektaşları yeni bir dizi deney gerçekleştirmiş ve 90 yaşına kadar çeşitli yaşlardaki sağlıklı bireylerin hipokampusunda binlerce olgunlaşmamış nöron tanımlamıştır [49]. Aynı grup daha sonra, Huntington hastalığı, frontotemporal demans, Parkinson hastalığı ve amiyotrofik lateral sklerozlu hastalarda bozulmuş hipokampal nörogenezi bildirmek için yeni nöronların gelişimini karakterize etmek için bir antikor kombinasyonu kullanmıştır [48]. Bu son çalışmalar [44, 48, 50], çok sayıda belirtecin (DCX, PSA-NCAM, Kalretinin, Kalbindin, Tau, NeuN, Sox2, MAP2, Nestin, Vimentin, S100Beta, HuC, Prox1, vb.) analizini içermiştir. Bu protein ve transkripsiyon faktörleri dizisi, yalnızca olgunlaşmamış nöronların değil, aynı zamanda sinir kök hücrelerinin, öncü hücrelerin ve proliferatif hücrelerin belirteçlerini de içerir. Tam olarak, kalan memeli türlerinde yetişkin nörogenezinin meydana geldiğini göstermek için kullanılan aynı belirteçlerdir. Bu belirteçlerin kullanımı, yaygın olarak kullanılan antikorların her zaman insan dokusunda çalışmadığı gerçeği dahil olmak üzere birkaç dezavantaja sahip olmasına rağmen. Dahası, Llorens-Martin grubu, ölüm sonrası gecikmenin, fiksasyon işleminin ve antijen geri kazanım protokollerinin, tüm süreci yeniden oluşturmak için kesinlikle kontrollü bir metodoloji gerektiren yetişkin nörogenez belirteçlerinin tespit edilebilirliğini güçlü bir şekilde etkilediğini ortaya koymuştur [3, 51]. Devam eden tartışmayı çözmek için, türler arasındaki farklılıkların dikkate alınarak, çoklu belirteçlerin veya tüm genomun analizi gereklidir. Bu tartışma henüz bitmemiş olsa da [45, 52,53,54], insan yetişkin beyninin yaşam boyunca yeni nöronlar üretme yeteneğine sahip olması oldukça olasıdır.
Ölüm sonrası insan örnekleriyle çalışma ile ilgili yukarıda belirtilen sınırlamalar göz önüne alındığında, bir sonraki nesil dizileme teknolojileri, yetişkin nörogenezinin alternatif değerlendirmesi için umut vadeden bir potansiyel ile ortaya çıkmaktadır. Tek hücreli/tek çekirdekli RNA dizilemesi (sc/sn-RNA-seq), ekspresyon profilini, hücresel çeşitliliği ve dokuların heterojenliğini tek hücre çözünürlüğünde değerlendirmek için kullanılabilir. Bu nedenle, kök hücrelerden tamamen olgun nöronlara kadar çeşitli hücre tiplerini karakterize etmek için kullanışlıdır [55]. Örneğin, Zhou ve meslektaşları [56], olgunlaşmamış nöronları tanımlamak ve insan hipokampusundaki bolluğunu nicelleştirmek için makine öğrenimine dayalı analitik bir yaklaşımla birlikte sn-RNA-seq kullanmıştır. Düşük frekanslı de novo üretim ve uzun süreli olgunlaşma yoluyla yetişkin insan hipokampusunda önemli sayıda olgunlaşmamış nöronun varlığını bildirmiştir, bu da diğer memeli türlerine kıyasla büyük bir fark göstermektedir (Şekil 1). Aynı doğrultuda, yakın zamanda yapılan bir çalışma, farklı hücre tipleri için yeni belirteçler ortaya koyarak maymunlarda ve insanlarda hipokampal yetişkin nörogenezini daha iyi anlama sağlamaktadır [23]. Son olarak, Franjic ve meslektaşları, altı insan donörden entorhinal-hipokampal kompleksin beş alt bölgesinden hücrelerde, ayrıca rhesus makaklarında ve domuzlarda örneklerde sn-RNA-seq gerçekleştirmiştir [57]. Verilerini farelerden yayınlanmış tek hücreli dizileme verileriyle karşılaştırmış ve domuzlarda ve makaklarda progenitörlerden granül hücrelere homolog bir yörünge bulmuş, ancak insanlarda bulamamıştır. Hem olgun hem de olgunlaşmamış granül hücrelerde ekspresyonunu bulmuş, böylece bu belirtecin yetişkin nörogenez için bir vekil olarak kullanılmaması gerektiğini göstermiştir. Aslında, alandaki çoğu tartışma, kemirgen kaynaklı işaretleyici genleri kullanan immünoboyamalarla nörogenezin doğrulanmasından kaynaklanmaktadır. İmmünoboyama çalışmaları, türler arasında önemli farklılıklar göz önüne alındığında önemli bir zorluk sunduğundan, bir sonraki nesil dizileme teknolojileri alana yeniden canlanma sağlamıştır.
Özetle, artan anatomik, biyokimyasal ve genomik kanıtlar, yaşam boyunca sağlıklı bireylerin hipokampusunda olgunlaşmamış nöronların varlığını desteklemektedir. Bu gözlem, yetişkin nörogenezinin yok gibi göründüğü koku alma soğancığıyla tam bir tezat oluşturmaktadır, ancak daha hassas araçlardan yararlanan yeni bir inceleme hala eksiktir. Evrimsel bir bakış açısından, memeli beyninin farklı bölgelerinde farklı olgunlaşma oranlarına sahip, farklı yetişkin nörogenez kalıplarını nasıl anlayabiliriz? Evrim seyri sırasında meydana gelen ve filogenetik gruplar arasında koku alma soğancığı hacminin azalmasıyla ilişkili iyi belgelenmiş koku alma yeteneklerindeki azalma, primat koku alma soğancığında yetişkin nörogenezinin yok olmasına katkıda bulunan önemli faktörler olmuş olabilir [58]. Aksine, striatum, evrim boyunca serebral korteks ile paralel olarak genişlemiş ve insanlar da dahil olmak üzere yüksek memelilerde özellikle iyi gelişmiştir. Striatumun genişlemesi, hareket koordinasyonuna, bilişe ve duygulara daha ağır bir bağımlılığı ima eder ve muhtemelen yetişkin nörogenezinin sağladığı yeni bir plastisite gerektirir. Bu olasılığı gündeme getirmek, kültürel olarak icat edilmiş bir özelliğin, bireysel uygunluğu artırmak için nesiller boyunca tekrarlanan doğal seleksiyon yoluyla içgüdüsel bir özelliğe dönüştüğü "Baldwin etkisi" ile ilgilidir [59]. Yetişkin nörogenezinin fonksiyonel önemi hakkında tartışmalar henüz bitmiş görünmüyor, çünkü bazı çalışmalar, özellikle yüksek bilişsel gelişim gösteren türlerde oranlarının çok düşük olması nedeniyle evrimsel bir kalıntı olarak görüyor [53].
Yaşayan organizmalarda olduğu gibi, önemli işlevler, çok sayıda düzenleyici tarafından uygulanan çoklu kontrollerin etkisine tabidir. Yetişkin nörogenez, nörotransmiterler ve trofik faktörler gibi bir dizi endogen beyin kaynaklı faktör tarafından düzenlendiği için bu kuralın bir istisnası değildir. Ayrıca, beyne dışarıdan gelen çeşitli faktörler de yetişkin nörogenezini etkiler (Şekil 2). Kapsamlı bir şekilde incelenen ilk faktör, stresin ve glukokortikoidlerin hipokampal nörogenez ve duygusal durumlar üzerindeki etkisidir [76]. Birçok çalışma, tekrarlayan stres durumlarının (sosyal yenilgi, yırtıcı kokuya maruz kalma, kısıtlama, ağrı koşullanması, tahmin edilemez kronik orta derecede stres), uykusuzluğun ve viral enfeksiyonun kemirgenlerde hipokampal nörogenezi azalttığını, kalori kısıtlamasının, antidepresanların veya fiziksel egzersizin ise artırdığını bildirmiştir [77, 78].
Daha yakın zamanda, gastrointestinal sistemimizde bulunan trilyonlarca mikroorganizmanın da yetişkin nörogenezi derinden etkilediği bildirilmiştir. Bu, çevresel faktörleri, stresi, yetişkin nörogenezi ve duygusal durumları birbirine bağlayan süreçlere yeni bir ışık tutmuştur. Bağırsak mikrobiyomunun bileşimi, doğum şekli (vajinal vs. sezaryen), diyet bileşimi, fiziksel egzersiz, stres veya yaşlanma gibi çeşitli yaşam tarzı faktörlerinden etkilendiğinden [79], yaşam tarzı faktörlerinin hipokampal nörogenez sürecinde doğrudan mı yoksa dolaylı olarak mikrobiyom kaynaklı nörogenik faktörleri değiştirerek mi yoksa her ikisiyle de etki ettiğinin net olmadığı görülmektedir (Şekil 3). Her durumda, germ-free (GF) kemirgenler [80], mikrobiyota transfer çalışmaları [81, 82] ve diyet takviyesi veya antibiyotik tedavisi ile yapılanlar gibi mikrobiyota hedefli müdahaleler [83, 84] yoluyla artan kanıtlar, yetişkin hipokampal nörogenez için bağırsak mikrobiyotasının bileşiminin önemini vurgulamaktadır (bkz. [85]). Örneğin, stresli farelerden naif farelere mikrobiyotanın aktarımı, azalmış hipokampal nörogenez, değiştirilmiş serum metabolit seviyeleri ve umutsuzluk benzeri davranışların ekspresyonu da dahil olmak üzere depresyonun belirtilerini aktarmak için yeterlidir [86, 87].
MDD'den muzdarip hastaların bağırsak mikrobiyomlarında benzersiz imzalar taşıdıkları bulunmuştur. Depresif hastalarda hem mikrobiyal çeşitlilik hem de mikrobiyal zenginlik önemli ölçüde azalmıştır (disbiyoz adı verilen bir süreç) ve bu atipik mikrobiyota imzası sağlıklı, naif sıçanlara aktarıldığında, alıcı kemirgenler kaygı benzeri ve anhedoni davranışları göstermiştir [88]. Bu etkileri elde etmek için bağırsak mikrobiyotasının ya kan dolaşımına [86, 87] ya da vagus siniri yoluyla sinirsel bir yola ihtiyacı vardır [89] (Şekil 3). Çarpıcı bir şekilde, fluoksetin gibi bir antidepresanın etkinliği bile bağırsak mikrobiyota bileşimindeki değişikliklerden etkilenmektedir. Örneğin, stres kaynaklı bağırsak mikrobiyotasındaki değişiklikler, beyin serotoninini tüketerek fluoksetin etkinliğini azaltır [87]. Bu nedenle, anti-nörogenik mikrobiyota, triptofan metabolizmasını serotonin sentezinden kinurenin üretimini değiştirerek inhibisyon etkisini uygular.
Son zamanlarda edinilen tüm bilgilere rağmen, potansiyel bir mikrobiyota temelli duygusal bozukluk tedavisini düşünmeden önce bağırsak mikrobiyotasının hipokampal nörogenezi nasıl mekanik olarak etkileyebileceğini daha iyi anlamak için daha fazla araştırmaya ihtiyaç vardır. Bugün, bağırsak mikrobiyotasının insan yetişkin hipokampal nörogenezini artırma yeteneğiyle ilgili klinik sonuçlar oldukça sınırlıdır. Duygusal bozukluklarla ilişkili mikrobiyota disfonksiyonunun klinik biyobelirteçlerinin tanımlanması, ruhsal bozuklukları tedavi etmek için yeni tedavi seçeneklerini dikkate almak için önemli bir adımdır.
Kemirgenlerde elde edilen veriler, seçici serotonin geri alım inhibitörleri, noradrenalin geri alım inhibitörleri, trisiklikler veya monoamin oksidaz inhibitörleri gibi geleneksel antidepresan sınıflarının, hepsinin hipokampal nörogenezi artırdığını [109, 110] veya kronik stres maruziyetiyle azalmalarını önlediğini göstermiştir [111,112,113]. Bu tedavilerde gözlemlenen iki ila dört haftalık gecikme, nörogeneze bağlı bir mekanizmayla uyumludur. Bununla birlikte, bu geleneksel antidepresan ilaçların, hayvan modellerinde dendritik omurga yoğunluğu düzenlemesi gibi başka etkileri de sergilediğine dikkat etmek önemlidir [114, 115]. İlginç bir şekilde, son zamanlarda fluoksetinin, kemik iliği gibi periferik organlarda öncü hücre yenilenmesini uyarabileceği gösterilmiştir [116], bu da antidepresanların beyin ve periferik organlar üzerindeki etkisine daha fazla karmaşıklık katmaktadır.
Depresyon alanında geliştirilen veya geliştirilmekte olan en son tedaviler (yani, ketamin, esketamin veya psilosibin), hızlı bir BDNF üretimi ve dendritik omurga yeniden büyümesi etkisiyle nöroplastisite üzerinde açık bir etkiye sahiptir. Bu etki mekanizması, uzun süreli antidepresan etki üretmek için tekrarlayan uygulamaların gerekli olmasına rağmen hızlı etkinliklerini açıklar (ketamin için bkz. [117,118,119]; psilosibin için [120, 121]). Önemli olarak, hem ketaminin hem de psilosibinin hipokampal nörogenez üzerinde de etkisi olduğu gösterilmiştir [122, 123]. Son olarak, nöromodülasyon tedavilerinin (yani, elektromanyetik uyarılar, elektrik akımı veya ultrason ile sinir devre aktivitesini modüle eden terapötik yöntemler) kemirgenlerde nörogenezi uyarmada açık bir etkiye sahip olduğu gösterilmiştir (inceleme için bkz. [124]). Sağlam veriler, elektrokonvülsif tedavi (EKT)'nin hipokampal nörogenez üzerindeki etkisini ortaya koymuştur [125, 126]. Tekrarlayan transkraniyal manyetik stimülasyon [127], derin beyin stimülasyonu [128] ve vagus siniri stimülasyonu [129] gibi diğer stimülasyon modaliteleri de yetişkin nörogenezi değiştirir [124].
Tedaviler ve nörogenez arasındaki bağlantı, antidepresan tedavilerine maruz kalan hastaların, tedavi edilmemiş depresif hastalara kıyasla artmış hipokampal nörogenez sergilediğini gösteren ölüm sonrası çalışmalarla desteklenmektedir [130,131,132] (bkz. Tablo 1). Klinik çalışmalar ayrıca, MDD hastalarında bildirilen hipokampal hacim azalmasının antidepresan ilaçlar tarafından karşılandığını göstermiştir [133, 134]. Aynı doğrultuda, hipokampal hacim kaybının hastalarda [135, 136] veya EKT ile tedavi edilen hastalarda [137] antidepresan yanıtının bir göstergesi olduğu gösterilmiştir.
Depresif hasta popülasyonunda düşük dereceli inflamasyon kanıtlanmış ve anti-inflamatuar ilaçlar pilot çalışmalarda umut vadeden sonuçlar göstermiş olsa da, anti-inflamatuar ilaçlar henüz depresyon için monoterapi veya ek tedavi olarak endikedir değildir (inceleme için bkz. [138]). Bununla birlikte, kronik strese maruz kalan farelerde, minosiklini kaygı-depresif benzeri fenotipi ve hipokampal nörogenezdeki azalma ile ilişkili stres kaynaklı mikroglia aktivasyonunu giderebilir [139].
BD'ye gelince, ruh hali düzenleyici lityum (Li), altın standart tedavidir, ancak antipsikotikler (örneğin, klozapin veya haloperidol) ve antikonvülsanlar (örneğin, lamotrijin veya valproik asit) gibi diğer moleküller kullanılabilir. Farelerde, birkaç çalışma, Li'nin nörogenez düzenlemesi yoluyla etki edebileceğini düşündürmektedir, ancak net doğrudan kanıt hala eksiktir [140, 141]. Yakın zamanda yapılan in vitro deneyler, insan hipokampal öncü hücrelerinde yüksek dozda Li tedavisinin nöroblast üretimini artırdığını göstermiştir [142]. İnsanlarda, MRI verileri, Li'nin BD hastalarının hipokampusunda biriktiğini göstermiştir [143] ve çok sayıda çalışma, Li tedavisinden sonra hipokampal hacimde bir artış göstermiştir (inceleme için bkz. [144]). Hipokampal hacimdeki değişiklikler, Li tedavisine yanıtı ve bilişsel işlevsellikteki iyileşmeyi ilişkilendirmektedir [145, 146].
Özellikle valproik asit olan antikonvülsan ruh hali düzenleyiciler—gebe kadınlara reçete edildiğinde teratojenik etkiler ve nörogelişimsel bozukluk riskinin artması keşfedilmeden önce yaygın olarak ruh hali düzenleyici olarak kullanılmıştır—yaygın ruh hali düzenleyicilerdir [147, 148]. Valproik asit, kemirgen korteksinde hipokampal nörogenezi ve nöronal büyümeyi uyarır [149]. BD hastalarında, valproik asit, Li tedavisinin aksine hipokampus hacminde değişiklikle ilişkilendirilmemiştir [145, 150]. Özellikle bipolar depresyon profilaksisi için kullanılan bir tedavi olan lamotrijin için veriler çok daha sınırlıdır. Hem artış [151] hem de sıçan hipokampusunda nörogenezde azalma gösteren tutarsız sonuçlar mevcuttur [152].
Son olarak, antipsikotik tedaviler de ruh hali düzenleyici olarak kullanılabilir. Antipsikotik ilaçlar, dopamin D2 reseptör antagonizması ile karakterize edilen tipik veya birinci nesil antipsikotiklere (haloperidol ve risperidon gibi) ve D2 reseptör antagonizmasını ve serotonin iletimi üzerindeki etkiler de dahil olmak üzere ek farmakolojik özellikleri paylaşan atipiklere (aripiprazol, olanzapin ve klozapin gibi) ayrılır. Olanzapin [153, 154], aripiprazol ve klozapin [154] dahil atipik antipsikotiklerin kronik uygulanmasının hipokampal nörogenezi artırdığı, haloperidolün ise etkisi olmadığı [155,156,157] veya negatif olduğu bildirilmiştir [154]. İlginç bir şekilde, bazı çalışmalar, striatum, prefrontal korteks ve SVZ dahil olmak üzere diğer beyin bölgelerinde nörogenezde antipsikotik tedavi ile bir korelasyon bulmuştur [155, 157]. Atipik antipsikotiklerin nörogenez üzerindeki olumlu etkisi, GSK3β/β-katenin yolunu ve BDNF üretimini etkileyen kısmi 5HT2A reseptör antagonizmasından ve/veya 5HT1A reseptör agonizmasından kaynaklanabilir [158]. Bu nedenle, tipik ve atipik antipsikotikler arasındaki sınıflandırma, nörotransmiter reseptör afinitesiyle ilgili farmakolojik özelliklerine göre değil, nörogenez üzerindeki etkisine dayalı olabilir. İlginç bir şekilde, bu moleküller ayrıca, hipokampal hacim azalmasının da gösterildiği [159] ve aripiprazol tedavisiyle tersine çevrildiği şizofreni spektrum bozukluğu hastalarının tedavisinde de kullanılır [160].
Son olarak, ruh hali bozukluklarının yönetiminde nörogenez ile bağlantılı diğer farmakolojik olmayan müdahaleler, fiziksel aktivite gibi tartışılmaktadır (inceleme için bkz. [161]). Farelerde, gönüllü fiziksel egzersiz, hipokampal nörogenezde bir artışla [162,163,164] ve bilişsel işlevlerin