Bugün öğrendim ki: Bilim insanları mitokondri sorunlarının otizme katkıda bulunduğunu tespit ediyor.
Otizm spektrum bozukluğu (OSB), çocukluk çağındaki en sakatlayıcı kronik bozukluklardan birini temsil eden nörogelişimsel bir durumdur [1]. Sosyal etkileşimlerde anormallikler, sınırlı ilgi alanları, iletişim eksiklikleri ve tekrarlayıcı davranışlar sergiler [2]. OSB'li çocuklar sıklıkla zorbalığa maruz kalırlar [3] ve düşmanlık, izolasyon veya hatta kendine zarar vermeyle tepki verirler [4]. Bu özellikler, rutinlere esnek olmayan bir bağlılık ve duyusal uyarılara yetersiz tepkiyle ağırlaşır. Yavaş yavaş, bu bozukluk kalıcı bir ömür boyu süren engelliliğe dönüşür [5]. Son çalışmalar, OSB'nin küresel prevalans oranının 36 çocukta 1 olduğunu belirlemiştir [6]. Son on yıl, OSB teşhisi konan çocuk sayısında dramatik bir artışla karakterize edilmiştir. ABD'de OSB'li çocukların prevalans oranının 2017 ile 2020 yılları arasında %52 arttığı bulunmuştur [7]. OSB'nin, bu bozukluğun kalıcılığı, eşlik eden komorbiditeler ve otistik hastalar için yetersiz sağlık desteğiyle ilişkili önemli düzeydeki stres nedeniyle, teşhis konan kişinin tüm ailesini etkilemesi muhtemeldir [8, 9]. OSB tedavisi için belirteçleri ve tedavi hedeflerini bulmak, küresel ekonomiyi önemli ölçüde etkileyecektir.
OSB'nin çeşitli bir etiyolojisi vardır. Bununla birlikte, OSB'nin davranışsal eksikliklerinin altında yatan ortak mekanizmaların bulunabileceğine inanılmaktadır [10]. Bu mekanizmaları hedeflemek, etkili OSB önleme ve tedavi yöntemlerinin geliştirilmesini amaçlayan yeni tedavi yaklaşımlarıyla sonuçlanabilir [11]. Bu hedefleri içeren bir organel, mitokondri olabilir. Mitokondriler birçok ortak moleküler yolu içerir ve beyin dokuları için ana enerji kaynağıdır. "Hücrenin enerji santrali" olarak önemli rolünün yanı sıra, bu organeller hücresel metabolizma, redoks durumu, hücre içi kalsiyum sinyalleşmesi ve programlanmış hücre ölümü mekanizmalarının da önemli düzenleyicileridir [12,13,14,15]. Mitokondriyal fonksiyonların OSB hastalarında sıklıkla bozulduğu gösterilmiştir [16]. Bu, kısmen otistik çocuklarda mitokondriyal DNA (mtDNA) mutasyonlarıyla ilişkili olabilir [16]. OSB bireylerindeki mitokondriyal disfonksiyonlar, toksinler, bağışıklık uyarımı, ilaçlar ve metabolik anormallikler de dahil olmak üzere hem endojen hem de eksojen çeşitli risk faktörlerinden de kaynaklanabilir [17]. Bu nedenle, OSB, mitokondriyal yapı ve fonksiyonlardaki değişikliklerle yakından ilişkilidir; bu da bu organelleri farklı etiyolojili OSB hastalarında olası bir son efektör yapar.
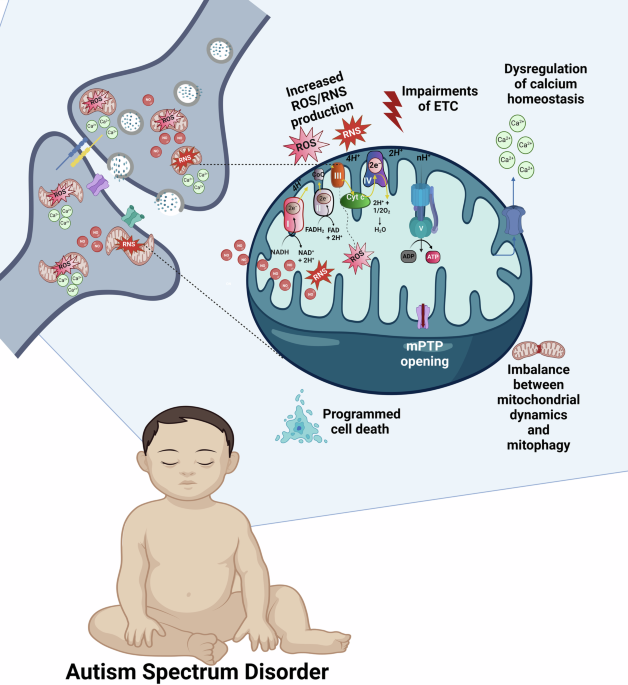
Bu derlemede, OSB ile ilgili çeşitli mitokondri ile ilişkili patolojik süreçleri ve bunlar arasındaki etkileşimi tartışıyoruz. OSB'de mitokondrinin çok yönlü rolü Şekil 1'de şematik olarak sunulmuştur.
Fizyolojik koşullar altında beyin mitokondrilerinin fonksiyonları
Ağırlığı vücut ağırlığının yaklaşık %2'sini oluşturan insan beyni, vücudun tamamının oksijeninin %20'sini tüketir. Mitokondriyal oksijenin çoğu, oksidatif fosforilasyon (OXPHOS) yoluyla mitokondriyal elektron taşıma zinciri (ETZ) tarafından ATP üretimi için kullanılır [18]. OXPHOS iki kısımdan oluşur: ETZ ve kemiosmoz. ETZ dört kompleks içerir. Kompleks I, NADH dehidrojenaz, flavin mononükleotid ve sekiz demir-kükürt kümesinden oluşur; Kompleks II süksinat dehidrojenazdır; Kompleks III, sitokrom b, Rieske alt birimleri ve sitokrom c proteinlerini içerir; ve Kompleks IV, sitokrom c oksidaz içerir. Kemiosmoz, OXPHOS'un çok üniteli enzim ATP sentazı olan Kompleks V tarafından gerçekleştirilir ve ETZ tarafından oluşturulan proton gradyanının enerjisini kullanarak ATP üretir [19]. Önemli olarak, normal beyin fonksiyonu için gerekli ATP'nin %93'ü mitokondri tarafından sağlanır [20]. Bu enerji, aşağıda açıklanan ve çok enerji gerektiren bir süreç olan sinaptik iletimini destekler. ATP, iyon gradyanlarını destekleyen iyon pompaları için enerji sağlar, vezikül geri dönüşümünü ve mitokondriyal hareketliliği sağlar.
Mitokondriyal Ca2+ uniporter (MCU) yoluyla mitokondriyal matriksine giren sitozolik Ca2+, pirovat dehidrojenaz fosfatazı aktive ederek OXPHOS'u uyarır; bu da pirovat dehidrojenaz kompleksinin aktivitesini artırır [21]. Alfa-ketoglutarat dehidrojenaz ve izositrat dehidrojenaz gibi diğer mitokondriyal sitrat döngüsü enzimleri de Ca2+ tarafından aktive edilebilir [21, 22]. Mitokondriler, mitokondriyal geçirgenlik geçiş gözenekleri (mPTP) veya Na+/Ca2+ değiştirici yoluyla sitozole Ca2+ salabilir [23, 24]. Bu, sitozolik Ca2+'nın birikmesiyle, ardından sinaptik vezikül ekzositozunun aktivasyonu ve nörotransmiterlerin salınmasıyla sonuçlanır.
Mitokondriler ayrıca reaktif oksijen türlerinin (ROS) ve reaktif azot türlerinin (RNS) ana kaynağıdır. Fizyolojik koşullar altında ROS ve RNS üretimi düşük seviyelerde tutulur [25, 26] ve hücre sinyalleşmesi, homeostaz, vasküler tonus ve bağışıklık reaksiyonları dahil olmak üzere çeşitli fizyolojik fonksiyonları düzenlemek için kullanılır [27]. Bunlar, süperoksit anyon radikali (O•–), hidroksil radikali (OH·), hidrojen peroksit (H2O2), singlet oksijen (1O2), nitrik oksit (NO) ve peroksinitrit (ONOO−) dahil olmak üzere moleküler oksijen ve azottan oluşan çeşitli serbest radikaller ve reaktif molekülleri içerir [28]. ROS ve RNS, gelişim sırasında ve normal doku dönüşümünde doku yeniden modellemesi için gerekli olan apoptoz gibi programlanmış hücre ölümünü tetikleyebilir [29, 30], proliferasyon, farklılaşma, nöronal kök hücrelerin olgunlaşması, dendritik süreçler ve sinaptik plastisite [31,32,33].
Gelişen sinir sistemi ve kritik süreçleri mitokondrideki OXPHOS tarafından üretilen ATP'ye çok fazla bağımlı olduğundan, olgunlaşmamış beyin enerji tedarikindeki hatalara karşı son derece savunmasızdır [34, 35]. Ayrıca, patolojik koşullar altında, yaşamı destekleyen bir organelden mitokondri, aktif olarak ölümü destekleyen bir organel haline gelir [36]. Bu süreç, gerekli miktarda ATP üretememe ile ETZ bozulması, telafi edilmemiş ROS ve RNS üretimi ve çeşitli moleküllerin bozulmasıyla birlikte mitokondriyal ve hücre bütünlüğünün kaybına ve programlanmış hücre ölümünün ve nekrozun aktivasyonuna yol açar. Mitokondriyal disfonksiyonun tüm bu sonuçları nörogelişimsel süreçleri bozabilir ve mitokondriyal bozuklukların OSB gibi nörogelişimsel bozukluklarla bağlantılı olması şaşırtıcı değildir [34]. Ayrıca, mitokondriyal fonksiyonların ve bütünlüğünün, toksinler, bağışıklık aktivasyonu, ilaçlar ve metabolik bozukluklar da dahil olmak üzere OSB'nin birçok risk faktöründen etkilenebileceği bulunmuştur [17]. Bu mitokondri ile ilgili mekanizmaların ortaya çıkarılması, OSB'nin ortak yollarına ışık tutabilir [11].
Sinaptik iletişimde mitokondrinin rolü
Beyin mitokondrileri tarafından üretilen enerjinin çoğu [18], sinaptik iletişim için kullanılır [20]. Bu, mitokondrinin beyin fonksiyonlarındaki çok önemli rolünü belirler. İlginç bir şekilde, sinapslardaki mitokondri sayısı çok yüksektir. Tahmin edilen enerji ihtiyacını aşar [20]. Bu, sinaps mitokondrilerinin sinir uçlarında, nöronların ateşleme olasılığını doğrudan etkileyebilen Ca2+ tamponlamasını içerebilecek ek işlevlere sahip olduğu anlamına gelir [37, 38].
Önceki çalışmalar, mitokondrinin iki ana havuzunu önermektedir: hareketli ve hareketsiz [39, 40]. Genel olarak kabul edilen, gelişen nöronlarda her havuzun mitokondrilerin yaklaşık %50'sini kapsadığıdır [41]. Bununla birlikte, nöronların olgunlaşmasıyla mitokondriyal taşımacılık önemli ölçüde azalır [42, 43]. Mitokondriyal taşıma ve dağılım, sinaptik aktiviteyle ilişkilidir [44]; presinaptik uçlardaki ve postsinaptik dendritik dikenlerdeki birikimleri, sinaptik aktivite arttığında artar [31]. Mitokondriyal taşıma, sitoskeleti içeren özel bir mekanizma ile gerçekleştirilir. Mikrotübüle bağlı motorlar dynein-dynactin, Ca2+-bağımlı mitokondriyal Rho GTPaz 1 (Miro1) ve taşıma kinesin proteinleri 1 ve 2 dahil olmak üzere bağlama proteinleri yoluyla mitokondrilere bağlanan kinesin-1 tarafından aracılık edilir [45]. Akson boyunca mitokondri taşımacılığının engellenmesindeki ilk adımın, kinesinlerin ve dyneinlerin, Miro/Milton ve sinaphilin (SNPH) anahtar adaptörlerinin birleşik eylemlerini içeren mikrotübüllerden mitokondrilerin Ca2+-bağımlı salınımı ile gerçekleştirildiği öne sürülmüştür [46, 47]. Lin ve ark., primer kortikal nöronlar üzerinde yapılan deneylerde, SNPH'nin ayrıca geç endosomlarla veziküller oluşturarak mitofagiden bağımsız olarak aksonlardaki hasarlı mitokondrilerin uzaklaştırılmasını teşvik ettiğini bulmuşlardır [48]. Diğer, henüz bilinmeyen mekanizmalar da akson terminallerinde veya diğer yerlerde mitokondrinin "bağlanmasına" katkıda bulunabilir [41].
Mitokondriyal morfoloji, akson ve dendritler olmak üzere iki nöronal bölmede lokalizasyonlarına bağlıdır [41]. Örneğin, kortikal piramidal nöronlarda, dendritik mitokondrilerin uzun, tübüler şekilde sunulduğu ve dendritik dalların %70-80'ini kapladığı bulunmuştur. Bu arada, akson mitokondrileri, akson hacminin %10'undan daha azını kaplayan dikkat çekici bir şekilde standart küçük bir boyuta sahiptir [49, 50]. Bu morfolojik değişkenliğin, ATP üretimi ve Ca2+ tamponlama gibi mitokondriyal fonksiyonları etkilemesi muhtemeldir. Bununla birlikte, bu farklılıkların nöronal gelişim ve fonksiyonu üzerindeki etkisi bilinmemektedir [41].
Mitokondrinin Ca2+ döngüsü düzenlemesinde ve ATP üretimindeki yer alması, bu organelleri nörogelişim sırasında ve yetişkin beyninde sinaptik fonksiyon için çok önemli hale getirir. Nörotransmiter içeren sinaptik veziküllerin (SV) ekzositozu, presinaptik boutonun uyarılması sırasında voltaj kapılı Ca2+ kanalları aracılığıyla Ca2+ girişine göre başlatılır. Bu nörotransmiterin salınımı, sinapsin normal fonksiyonunu korumak için SV havuzunu korumak için SV'nin endositozuna bağlıdır. Presinaptik sitoplazmik Ca2+, sarkoplazmik retikulum Ca2+-ATPaz (SERCA) ile endoplazmik retikuluma (ER), plazma membran Ca2+-ATPaz ile hücre dışı alana ve MCU ile mitokondriyal matriksine dahil olmak üzere birkaç tamamlayıcı mekanizma ile tüketilebilir [51,52,53]. Ca2+ döngüsü ve SV ekzositozu için genetik olarak kodlanmış sensörlerle yapılan çalışmalar, mitokondrinin presinaptik Ca2+ temizliğindeki temel rollerini ortaya koymuştur [54, 55]. Mitokondri içermeyen hipokampal veya kortikal nöronların akson terminallerinin, tekrarlayan uyarıya yanıt olarak daha fazla Ca2+ biriktirdiği ve giderek daha fazla SV salınımını teşvik ettiği gösterilmiştir [55, 56]. Burada da, MCU'ya bağlı presinaptik Ca2+ alımının inhibisyonu, artan presinaptik sitoplazmik Ca2+ seviyelerine neden olmuş ve kısa süreli sinaptik plastisiteyi olumsuz etkilemiştir [55]. Önemli olarak, mitokondrinin artan nöronal aktiviteye yanıt olarak presinaptik boutonlara alınarak sinaptik uyarılabilirliğin nöronal uyarıma uyacak şekilde yeniden ölçeklendirilmesine katkıda bulunabileceği gösterilmiştir [56].
Mitokondri tarafından ATP üretiminin presinaptik olarak son derece önemli olduğu genel olarak kabul edilmektedir [45]. Nörotransmiter geri alımı, SV ve presinaptik veziküllerin endositozu, membran boyunca iyonların konsantrasyon gradyanlarının sürdürülmesi bir yana, gereklidir. Bu görüş, akson terminallerinde aktiviteye bağlı ATP üretimi gösteren bir çalışma tarafından desteklenmektedir [57]. Bununla birlikte, Lee ve ark., fizyolojik olmayan yüksek aksiyon potansiyeli uyarılarında bile, glikolizin veya mitokondriyal ATP sentezinin inhibisyonunun presinaptik ATP seviyelerinde sadece hafif değişikliklere yol açtığını bulmuştur [41]. Başka bir çalışma, mitokondrili veya mitokondrisiz akson terminallerindeki ATP seviyelerindeki değişiklikleri karşılaştırmıştır. Yüksek yoğunluklu nörotransmiter salınımı uyarımı (600AP) altında bile presinaptik boutonlar arasında bu parametrede hiçbir fark gözlenmemiştir [58]. Bu veriler, yetişkin beyinlerin memeli aksonlarında, presinaptik mitokondrinin muhtemelen ana ATP kaynağı olmadığını göstermektedir. Yazarlar, glikolizin veya diğer ATP üretim yollarının, sinaptik aktivite için gerekli yeterli ATP'yi sağlayabileceğini öne sürmektedirler [41].
Sinaptik iletişimdeki mitokondrinin rolü üzerine yapılan çoğu çalışma, organelin presinaptik havuzuna odaklanmıştır. Bu arada, postsinaptik mitokondrinin rolü daha az araştırılmıştır. Mitokondri esas olarak dendritik gövdelerde bulunur, ancak dikenlere de ulaşabilir [59]. Mitokondrinin dendritik havuzunun önemi, hipokampal nöronlarda, dendritlerdeki mitokondrilerin tükenmesinin sinaps ve diken sayısını azaltması gerçeğiyle doğrulanmıştır [31]. Dendritik postsinaptik Ca2+ döngüsü, sinaptik entegrasyon ve gen ekspresyonunun düzenlenmesi için önemlidir [41]. Dendritik Ca2+'nın ana kaynakları ER ve hücre dışı alandır. Bununla birlikte, 3B seri elektron mikroskobu kullanan çalışmalar, dendritik ER'nin mitokondrilerle birçok temas bölgesine (MAM'ler, mitokondri ile ilişkili membranlar) sahip olduğunu göstermiştir [60]. MAM'ler, SERCA, ER kanalları inositol 1,4,5-trifosfat reseptörleri, glikoz düzenlenmiş protein 75, MCU ve voltaj bağımlı anyon kanalı (VDAC) yoluyla nöronal Ca2+ konsantrasyonunun düzenlenmesi için gereklidir [61]. Ayrıca, sinaptik ER'den salınan Ca2+'nın önemli bir kısmının MAM'lerde mitokondrilere doğrudan taşındığı görülmektedir [62]. Yeni bir MAM proteini olan PDZ alanı içeren protein 8'den yoksun kortikal piramidal nöronların dendritlerinde, sinaptik uyarım sırasında ER'den salınan Ca2+'nın önemli bir kısmı sitozolde birikir ve lokal dendritik Ca2+ seviyelerini yükseltir. Bu veriler, dendritlerdeki MAM'lerin dağılımının ve kapsamının Ca2+ dinamiklerini düzenleyebileceğini ve böylece dendritlerdeki sinaptik entegrasyon ve plastisite özelliklerini belirleyebileceğini göstermektedir [62].
Sinaptik gelişim anormallikleri, OSB'ye önemli katkıda bulunanlar gibi görünmektedir. OSB'deki bu sapmaların önemini vurgulamak için, bu bozukluk artık "gelişimsel sinaptopati" olarak adlandırılmaktadır [63]. OSB'deki sinaptik iletimin anormalliklerinin mitokondriyal sapmalarla yakından ilişkili olduğunu belirtmek gerekir. Farklı OSB ile ilişkili sendromlardaki sinaptik ve mitokondriyal sapmalar, aşağıda "OSB ile ilişkili sendromlardaki mitokondriyal ve sinaptik anormallikler" bölümünde ele alınmaktadır.
OSB'de mitokondriyal disfonksiyon
Metabolik çalışmalar, mitokondrileri OSB'nin patofizyolojisiyle ilişkilendirmiştir [64]. 1985 yılında Blass ve Coleman, dört otistik hastanın plazmasında artmış laktat seviyeleri bildirmiş ve bunun OXPHOS'taki sapmaların bir sonucu olduğunu öne sürmüştür [65]. On üç yıl sonra Lombard, OSB hastalarındaki metabolik değişiklikler hakkındaki verileri gözden geçirdi. Laktik asidoz, idrarda Krebs döngüsü metabolitlerinin artmış konsantrasyonu, plazmada karniti seviyelerinin azalması, beyinde glikoz kullanımının azalması ve bu hastalardaki ATP seviyelerinin düşmesinin mitokondriyal disfonksiyonla ilişkili olduğunu varsaydı [66]. Bu verilere dayanarak Lombard, OSB'nin mitokondriyal bir hastalık olduğunu öne sürdü [66]. OSB hastalarındaki metabolik anormallikler hakkındaki veriler birikmeye devam etmektedir (bu veriler Tablo 1'de özetlenmiştir). Bu nedenle, OSB teşhisi konan çocukların kanındaki pirovat, karnitit ve ubikinon gibi mitokondri ile ilgili metabolitlerin seviyeleri, tipik olarak gelişen akranlarının seviyelerinden önemli ölçüde farklı görünmektedir [35]. Correia ve ark., incelenen OSB çocuk kohortunun %17'sinde plazmada yüksek laktat asidi seviyeleri bulmuş ve bunların %28'inde laktat/pirovat oranının arttığını göstermiştir [67]. 30 otistik çocuktan alınan kas biyopsileri, bu çocukların 7'sinde mitokondriyal bir defekt ortaya koymuştur [68]. Daha sonraki çalışmalar bu bulguları desteklemiştir. Örneğin, 60 OSB hastanın %8,3'ünde başarısız aerobik solunumun biyokimyasal belirteçleri bulunmuştur [69]. Bu belirteçler, artmış plazma alanin ve laktat seviyelerini ve bu hastaların idrarında 3-metil-glutakonik ve dikarboksilik asitler ve Krebs döngüsü ara ürünleri gibi organik asitlerin varlığını içerir [69]. Başka bir çalışmada, OSB çocuklarının %20'sinde plazma laktat seviyeleri ve laktat/pirovat oranı artmıştır [70]. OSB teşhisi konan başka bir hasta kohortunda, serbest ve toplam serum karnitit konsantrasyonunda azalma, pirovatta azalma ve alanin ve amonyak seviyelerinde artış gözlenmiştir [71]. 25 otistik çocuğun tıbbi muayene verilerinin incelenmesinde, bu hastaların %53'ünün pirovat seviyelerinin, %76'sının kan laktatının arttığını, bunların %20'sinde fibroblastlarda laktat/pirovat oranının arttığını ve %42'sinde idrar organik asit analizinin atipik sonuçlarıyla sunulduğunu bulmuştur [72].
ETZ aktivitesindeki bozulmalar dahil olmak üzere OSB hastalarında OXPHOS bozukluklarının kanıtları da toplanmıştır (Tablo 1). Bu çalışmaların sonuçları oldukça belirsizdir. Bu nedenle, Graf ve ark., OSB hastasından alınan iskelet kası biyopsisinden elde edilen mitokondrilerde anormal olarak artırılmış Kompleks I aktivitesi bildirmiştir [73]. Bu arada, Shoffner ve ark., mitokondriyal hastalığı olan 28 OSB çocuğunun iskelet kası biyopsileri arasında, %50'sinin Kompleks I defektleri, %18'inin Kompleks I ve III'ün kombine defektleri, %18'inin Kompleks I, III ve IV'ün kombine defektleri ve %14'ünün Kompleks V defektleri olduğunu bulmuştur [74]. Bu çocukların %71'inde anormal OXPHOS vardı. Kompleks I, III, IV ve V'deki defektler, otistik çocuklardan izole edilen mitokondriler üzerine yapılan birkaç başka çalışmada da bildirilmiştir [75,76,77]. OSB'nin Mecp2-308 fare modelinin beynindeki bir çalışma, mutant farelerin serebellum ve striatumunda Kompleks I, II ve V aktivitelerinde önemli bir azalmayla birlikte azalmış bir ATP üretimi göstermiştir [78]. Bu bulgular, OSB hastalarında OXPHOS'un en çok etkilenen bileşeninin Kompleks I olduğunu, ancak Kompleks III, IV ve V gibi diğer komplekslerin aktivitesinde anormalliklerin de bulunabileceğini göstermektedir.
OSB'nin klinik çalışmaları ve bu bozukluğun hayvan ve hücresel modelleri üzerinde yapılan deneyler, yetersiz mitokondriyal enerji üretiminin biyokimyasal endofenotıpını ortaya koymuştur. Bu fenotip, laktat asidi, pirovat ve karniti birikiminde, plazmada alanin aminotransferaz ve aspartat aminotransferaz seviyelerinde artışta [72], baskılanmış ETZ aktivitesinde ve azalmış mitokondriyal membran potansiyelinde (Ψm) kendini göstermiştir [79]. Yaşa bağlı metabolik değişiklikler, Chauhan ve ark. tarafından OSB hastalarının postmortem beyin örneklerinde araştırılmıştır [80]. 4-10 yaş arası çocuklarda büyük metabolik anormallikler ve artmış lipid hidroperoksit seviyeleri (oksidatif stres belirteçleri) gözlemlenmiştir, ancak yetişkinlerde gözlenmemiştir. Bu veriler, bu yaştaki otistik çocukların enerji eksiklikleri ve oksidatif stres gibi OSB ile ilgili faktörlere karşı özellikle savunmasız olduğunu düşündürmektedir. Bu grup tarafından OSB hastalarının sonraki ölüm sonrası incelemeleri yapılmıştır [81]. Bu çalışma, otistik hastaların frontal korteksinde pirovat dehidrojenaz ve Kompleks I ve V aktivitelerinde %30'dan fazla bir azalma bulmuştur. Kompleks III'ün anormal aktivitesi de otistik beyinlerin %29'unda tespit edilmiş ve bunların %29'unda çoklu komplekslerde defektler bulunmuştur [81]. Bu nedenle, OXPHOS komplekslerinin OSB ile ilgili defektleri konusunda bazı veri farklılıkları fark edilebilir. Bunlar, farklı metodolojik yaklaşımlardan ve OSB hastalarındaki klinik belirtilerin değişkenliğinden kaynaklanabilir.
Rossignol ve Frye, otistik çocuklarda mitokondri ile ilişkili genetik anormalliklerin prevalansını araştırmak için sistematik bir derleme ve meta-analiz yapmıştır [35]. Bu çalışma, incelenen OSB hasta kohortunun %21'inin mitokondriyal disfonksiyonla ilgili mtDNA veya nükleer DNA (nDNA) mutasyonları taşıdığını ortaya koymuştur. Diğer popülasyon tabanlı çalışmalar, OSB hastalarının yaklaşık %7'sinin OXPHOS disfonksiyonu olduğunu bulmuştur [70, 72]. Bu hastaların %23'ünde mtDNA anormallikleri gözlenmiştir [35]. Otistik hastalardaki mtDNA mutasyonlarının OSB'nin bir nedeni mi yoksa bir sonucu mu olduğu bilinmemektedir. Bununla birlikte, bazı araştırmacılar tarafından OSB fenotipinde mitokondriyal hastalığın işlevsel bir rolü önerilmiştir [74]. En iyi bilinen mitokondriyal hastalıklardan biri, mitokondriyal ensefalomiyopati, laktik asidoz ve inme benzeri episodlardır (MELAS) [82]. MELAS'ın, otizmle bağlantılı olduğu görünen A3243G mtDNA mutasyonundan kaynaklandığı bulunmuştur [83].
OXPHOS ve mitokondriyal bütünlük, mitokondriyal proteinleri kodlayan nDNA'daki eksiklikler tarafından da etkilenebilir. Filipek ve ark., 15q11-q13 kromozomunun tersine çevrilmiş bir duplikasyonuna sahip iki OSB vakası tanımlamıştır. Yazarlar, bu kromozomun gen ürünlerinin Kompleks III düzenlemesinde yer aldığını öne sürmüştür [84]. Mitokondriyal proteinlerden sorumlu diğer nDNA bölgelerindeki genler de OSB fenotipinde yer alabilir. Bu nedenle, 235 OSB hastası kohortunda, aday OSB bölgesi olan 7q32 bölgesi araştırılmıştır [85]. Bu bölgede, NADH-ubikinon oksidoreduktaz 1 alfa alt kompleksi 5 (NDUFA5) geninde iki tek nükleotid polimorfizmi otizmle güçlü bir şekilde ilişkilendirilmiştir. NDUFA5, ETZ'nin Kompleks I'inin bir parçasıdır ve mutasyonları OSB'ye katkıda bulunabilir [86]. Wang ve ark., 903 otistik proband-anne-kardeş üçlüsünden tüm ekzom analizini yapmıştır [87]. OXPHOS anormallikleri üretebilecek bölgeler olan polimorfik olmayan bölgelerde heteroplazmik mutasyon olasılığının, OSB çocuklarında etkilenmemiş kardeşlere göre %53 daha yüksek olduğunu bulmuşlardır. Bununla birlikte, bu çalışmanın aksine, yaklaşık 400 proband-baba çiftinin mitokondriyal genom dizilemesi, mtDNA mutasyonları ile OSB arasında bir bağlantıya dair hiçbir kanıt bulamamıştır [88]. Toplu olarak, otistik çocuklarda mitokondriyal disfonksiyonlarla ilgili genetik mutasyonlar tanımlanmıştır. OSB ile ilgili genetik mutasyonlar üzerine yapılan çalışmalarda önemli bir veri farklılığı fark edilebilir; bu, otistik spektrumun çeşitliliğiyle ilişkilendirilebilir. Bu mutasyonların OSB fenotipinde nedensel veya ilişkilendirici bir rolü olup olmadığı belirlenmelidir.
Bir araya getirildiğinde, otizm ve mitokondriyal solunum disfonksiyonu arasında güçlü bir bağlantıya işaret eden tartışılmaz kanıtlar toplanmıştır (Tablo 1'de özetlenmiştir).
OSB'de mitokondriyal Ca2+'nın rolü
Kalsiyum sinyalleşmesi, fizyolojik ortamlarda çeşitli mitokondri ile ilgili hücresel süreçlerin ve fonksiyonların kritik bir düzenleyicisidir. Normalde, hücredeki ve hücreler arası boşluktaki Ca2+ dağılımı, Ca2+ homeostazı mekanizmaları tarafından düzenlenir ve mitokondri bu süreçlerde kilit bir rol oynar [89]. Sitozolik Ca2+ seviyeleri arttığında, mitokondri Ca2+ konsantrasyonunun normalleşmesine katkıda bulunan bu iyonlar için yüksek kapasiteli bir depo haline gelir [89]. Mitokondrilerde Ca2+ birikmesi, Krebs döngüsünü ve OXPHOS tarafından ATP üretimini uyarır [90]. İlginç bir şekilde, mitokondri dışı Ca2+'nın da mitokondriyal metabolizmayı düzenlediği bulunmuştur. Bu, bir mitokondriyal aspartat/glutamat taşıyıcısı olan aralar yoluyla glutamatı mitokondriyal matriksine taşıyarak gerçekleştirilir [91, 92]. Yukarıda ("Sinaptik iletişimde mitokondrinin rolü" bölümünde) tartışıldığı gibi, Ca2+ sinyalleşmesi, bu organellerin nöronal Ca2+ tamponlamasına ve nörotransmisyonun desteklenmesine katıldığı postsinaptik bölgelerde mitokondrilerin birikiminde yer almaktadır [93]. Ca2+, presinaptik sinir uçlarından nörotransmiter salınımının düzenlenmesinde yer almaktadır. Bu arada, gama-aminobutirik asit (GABA) ve glutamat nörotransmiterleri, postsinaptik nöronlarda Ca2+ sinyalleşmesine katılır [93, 94]. Örneğin, iyonotropik glutamat reseptörleri ligand kapılı kalsiyum kanalları temsil ederken, GABA reseptörleri voltaj kapılı kalsiyum kanalları yoluyla kalsiyum girişini tetikler [94]. Dolayısıyla, Ca2+'nın subhücresel dağılımı, Ca2+ sinyalleşmesinin ince düzenlemesini belirler [95].
OSB dahil olmak üzere nörogelişimsel durumlarda, Ca2+ homeostazındaki bozulma, çeşitli hücresel süreçler üzerinde zararlı etkilere neden olabilir [15]. Ca2+ metabolize edilmez ve mitokondriyal Ca2+'nın aşırı yüklenmesi, elektrokimyasal proton gradyanını bozarak ATP eksikliğine ve ardından nekroza yol açabilir [89]. Mitokondriyal Ca2+ aşırı yüklenmesi ayrıca ROS üretimini artırarak ve mPTP'yi açarak apoptotik hücre ölümünü tetikler [96]. Bozulmuş Ca2+ homeostazı, göçü, proliferasyonu, Purkinje hücre gelişimini, dendritik ağaçlanmayı, sinaps oluşumunu ve bakımını etkileyebilir [94]. Ek olarak, mitokondriyal disfonksiyon oluşturan anormal Ca2+ sinyalleşmesi, nörotransmiter sinyalleşmesini olumsuz etkileyebilir ve uyarılma/inhibisyon dengesizliğine yol açabilir [94, 97, 98]. Tüm bu olumsuz etkiler OSB'ye katkıda bulunabilir.
Beyin mitokondrilerinden Ca2+ salınımının tetikleyicilerinden biri, astrosit reseptörlerine bağlı perisinaptik ATP olabilir. Bu ATP molekülleri, iç mitokondriyal membranın (IMM) depolarizasyonuna ve ROS oluşumuna neden olur [93]. Ayrıca, mitokondrilerden sitozole Ca2+ salınımı, mikroglial pürinerjik reseptörlere bağlı hücre dışı ATP tarafından aracılık edilebilir. Mitokondrilerden sitozole Ca2+'nın anormal salınımı, mikroglianın, nöroinflamasyonun ve sonuç olarak hücre ölümünün aktivasyonuna yol açar [29, 93]. Toplamda, mitokondriyal ve sitozolik Ca2+ döngüsünün dengesiz düzenlenmesi, mitokondriyal disfonksiyon, hücre sinyalleşmesinin bozulması, sitotoksisite ve oksidatif stres oluşturarak OSB patogenezine katkıda bulunur. Burada, oksidatif/nitratif/nitrozatif stresin OSB patogenezindeki rolünü ele alıyoruz.
OSB'de mitokondriyal ROS
Düşük seviyelerde ROS, otofaji, bağışıklık sistemi, hücre farklılaşması, hücre hayatta kalımı, programlanmış hücre ölümü ve hipoksiye adaptasyon dahil olmak üzere çeşitli fizyolojik fonksiyonları düzenler [27, 99]. Normalde, mitokondrilerdeki fazla ROS, sitoplazmada birkaç enzim ve enzimatik olmayan antioksidan [100] içeren endojen antioksidan sistem tarafından nötralize edilir; bunlar indirgenmiş glutatyon (GSH), C ve E vitaminleri, mitokondriyal matrikste Cu/Zn-süperoksit dismutaz (SOD) ve peroksisomlarda katalaz, glutatyon peroksidaz (GSH-Px) vb.'dir. GSH-Px'in farklı izoformları mitokondrilerde bulunur. Mitokondriyal GSH-Px1, GSH'nin oksitlenmiş glutatyona (GSSG) oksidasyonuna göre H2O2'yi H2O'ya dönüştürür [101]. GSH-Px4 ayrıca mitokondrilerde bulunabilir. Membran fosfolipidlerine oksidatif hasarın ürünleri olan lipid hidroperoksitlerini nötralize eder. Bir sistein bağımlı peroksidaz enzimi olan Peroksiredoksin (Prx) 3 de mitokondrilerde bulunurken, Prx5 sitozolde, peroksisomlarda ve çekirdekte de bulunabilir [28]. Prx'lerin işlevi, H2O2'yi sistein-SOH'ye oksitler. Sistein-SOH, başka bir sisteinle etkileşerek H2O ve bir disülfür bağı üretir. İkincisi, tiyoredoksin redüktaz tarafından daha fazla indirgenen tiyoredoksin (Trx) 2 tarafından indirgenebilir [28].
GSH ve diğer mitokondriyal enzimatik olmayan antioksidanlar ve antioksidan enzimler, hücrenin antioksidan kapasitesini belirler [102]. Endojen antioksidan sistemin zayıflaması, beynin antioksidan kapasitesini aşan kontrolsüz ROS üretimine yol açarak gelişimsel nörotoksisiteye neden olur. Beynin sınırlı antioksidan kapasitesi, yüksek enerji ihtiyacı, demir ve bakır gibi yüksek seviyelerde geçiş metali ve lipid peroksidasyonuna maruz kalabilecek yüksek konsantrasyonda çoklu doymamış yağ asitleri [103,104,105], sinir sistemini oksidatif strese karşı özellikle savunmasız hale getirir [106]. Bu nedenle, nöronlar oksidatif stresin